发布时间:2022/12/23 点击数:
发布时间:2022/12/23 点击数:前言
细胞治疗用制剂产品需要专门的处理以确保它们成功地从制造设施转移运输到患者身边。为了提供物流灵活性,目前的许多商业化模式都采用了冷冻细胞产品交付给医院诊所并存储的形式,然后根据需求解冻并注入患者体内。然而解冻后许多类型细胞的活力和扩增能力都受到冷冻过程带来的影响,统称为延迟性细胞死亡(DOCD),因而最终治疗剂量的疗效和效率直接受到低温细胞保存关键工艺参数的影响。所以了解低温保存对细胞的影响对细胞疗法的成功商业制造至关重要。
本文研究者在Jurkat T细胞模型中研究了一些关键过程参数(CPPs)对解冻后细胞存活率和增殖功能的影响。研究结果表明,在Biolife冷冻培养基配方的生物保存操作背景下,其他看似不重要和不相关的通常可能被忽视的工艺参数,也会对解冻后的细胞活力和增殖产生重大影响。
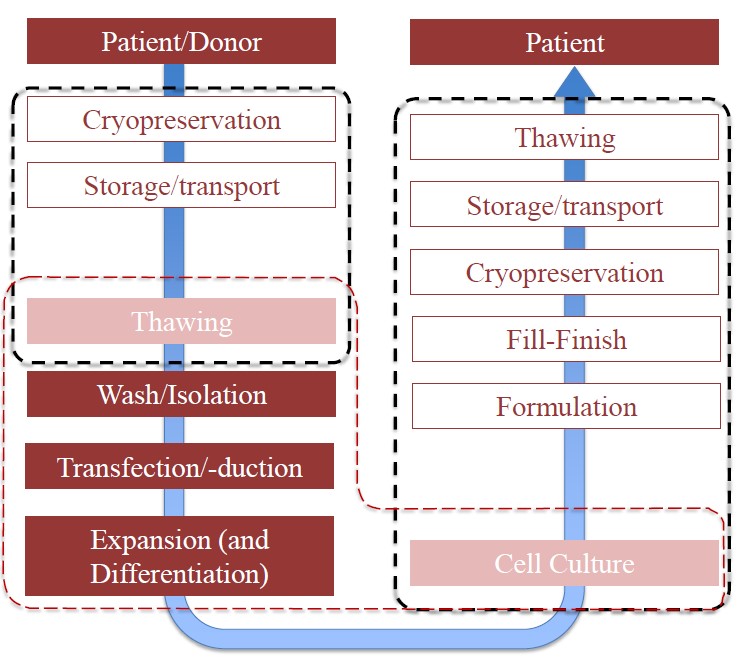
图-细胞治疗制剂制造中超低温保存的关键过程步骤
超低温保存的关键过程步骤与其紧接着的细胞培养处理结束前后的制造工艺重叠,因此细胞低温冻存过程直接影响细胞治疗制造工艺以及治疗剂量的疗效和效率。
01- 实验方法
· 细胞培养
Jurkat(克隆E6-1)在完全生长培养基(CGM)中培养
· 低温保存培养基/冻存液
本研究使用两种主要类型的低温培养基:
(1) 实验室自制款(HB组):用10% w/v溶解人血清白蛋白于勃脈力A(PlasmaLyte-A)中,并添加5%二甲亚砜(DMSO)制备且使用前进行无菌过滤;
(2) GMP制造的无血清和无蛋白CryoStor CS5(含5%DMSO)。
· 低温保存细胞流程
将Jurkat T细胞微球悬浮在指定的低温培养基中,放置在2ml 冻存管中,并在2-8℃下孵育15分钟,然后将冻存管转移到无LN2-程序降温仪以-1℃/分钟的速度冷冻保存。在达到-70℃后,将样品转移到LN2储存至少24小时。样品在指定条件下解冻,用完全培养基(1:10稀释)重悬,转移到37℃和5%的CO2培养箱。
· 低温保存关键过程参数 CPPs
对比了标准冻存液的冻存过程与自制冻存液备选方案针对一些不确定变量/易被忽视的参数值进行比较,如下所示:
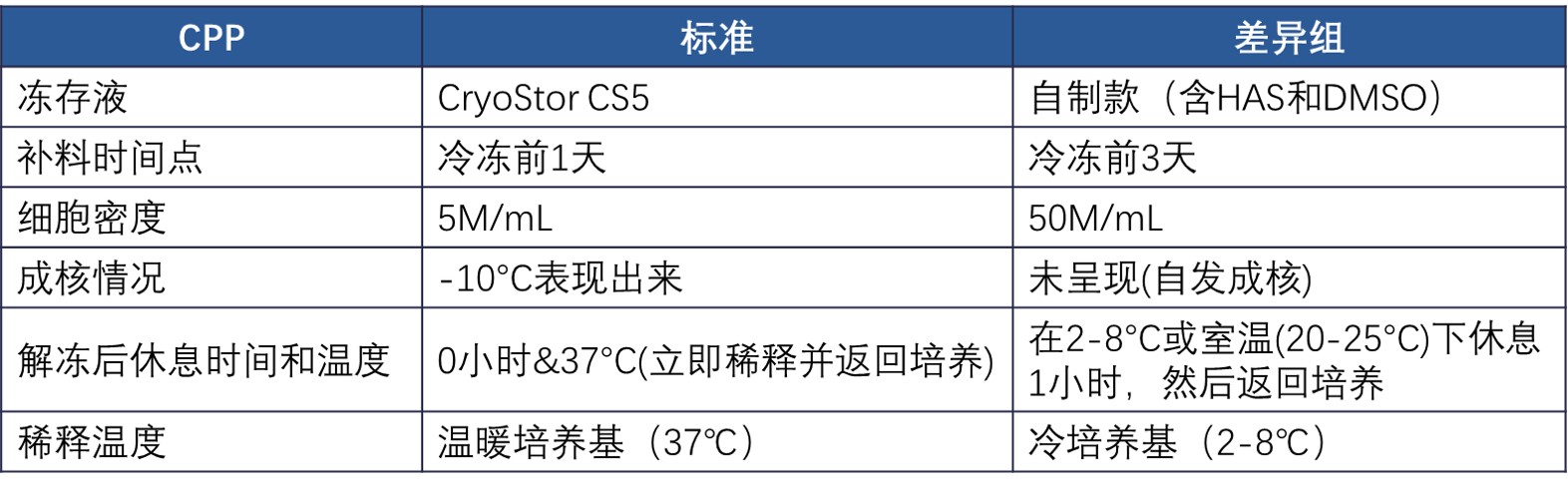
· 活力和扩增功能
在NucleoCounter NC-3000成像细胞仪上使用Via-1试剂盒,根据膜完整性评估立即解冻以及解冻后24小时内的细胞存活率和计数。
· 统计分析
对于所有测量数据,使用3-11个独立实验的平均值统计,并归一化到预冻结条件。通过Tukey校正和p<0.05设定先验,然后通过双向方差分析对各组进行统计学意义分析。
02- 实验结果
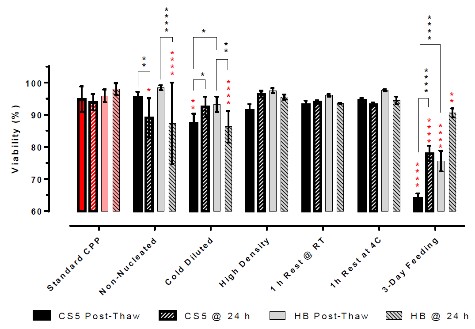
图1 - 解冻后24小时内使用膜完整性测定进行评估Jurkat T细胞活力
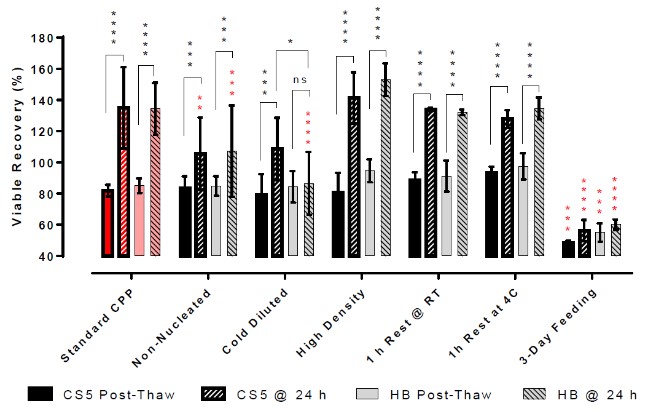
图2 - 使用膜完整性试验评估了解冻后Jurkat T细胞的可见复苏率和扩增性能。
1- 成核
解冻后立即检测对于成核和非成核样品的活率和回收率没有显著差异。然而在解冻后24小时的随访分析中显示,无核样品的存活率和增殖能力显著下降。这种负面影响在无论哪种类型的冻存培养基(自制冻存液或CryoStor CS5)都是观察到的,不过自制组的组间差异性(以SD表示)比CS5冷冻组大。
2- 稀释
解冻后在冷培养基中稀释导致Jurkat T细胞的活力显著下降和增殖缓慢。这可能是由于DMSO在低温下从细胞中缓慢去除,导致渗透细胞肿胀,导致细胞直接裂解或触发凋亡级联。当在温暖的培养基中稀释时,这种对细胞的负面影响将最小化。
3- 解冻后休息
与解冻后立即稀释的做法相比,在稀释成完全生长培养基之前在冷冻培养基中休息1小时对Jurkat T细胞的活力和增殖的影响最小。休息期间的温度似乎对试验结果没有显著影响,表明解冻后1 h的稳定性由两种冷冻培养基支持。
4- 细胞密度
无论是5 M/mL还是50 M/mL冷冻保存,与使用标准CPPs冷冻保存的细胞相比,Jurkat T细胞立即或解冻后24小时的存活率和增殖能力均无差异。在高或低细胞密度下,冷冻介质的性能在统计学上是相同的。
5- 冷冻培养基
结果表明,使用标准CPPs, CryoStor CS5和由PLA、10% w/v HSA和5%DMSO组成的自制配方,在保存Jurkat T细胞的活力和增殖能力方面表现相似。然而,CryoStor CS5似乎显着减少了稀释或随机成核造成的应力,因此,保护细胞免受低温保存CPPs(或非标准CPPs)变化的影响,从而提高了解冻后24小时的存活率和计数,并降低了结果的可变性。
6- 补料时间
本研究中最显著的CPP是冷冻保存前培养补料的时间。尽管在低温保存前,这是一种非常健康的培养物(存活率为93%),但解冻前3天补充培养物似乎更容易受到低温保存诱导的压力,因此在低温保存和解冻后增殖方面都有显着的损失。

—— 成立于1998年美国纳斯达克上市公司
03- 实验结论
-1-
解冻后立即对细胞活力和数量进行分析并不能反映冷冻保存过程成功与否。未优化的冷冻培养基的不良影响可能要到解冻后的24-48小时才能检测到,这归因于低温保存诱导存在着延迟性细胞死亡(DOCD)这一现象。另一方面优化的低温保存介质的加入可以防止DOCD的发生,减少了变异性从而可以更准确地估计了解冻后的活力和增殖功能。
-2-
低温保存前的补料时间和培养基的变化对冷冻保存过程的结果有重要影响,这可能是归因于一些参数,包括在冷冻前活力试验中没有体现出来的压力积累,但与DOCS结合从而导致解冻后活力和功能的显著损失。
-3-
冰成核的随机性本质上导致了细胞在低温保存过程中所承受的低温保存诱导应力的变化。因此适当的成核对模型T细胞的生存能力和增殖能力有显著影响。
-4-
在37°C介质中稀释(类似于患者给药情景)是解冻后的推荐稀释方法,因此强烈建议如此操作并且出于分析目的,细胞也应在温暖介质中稀释以尽量减少在洗涤过程中渗透性细胞肿胀和溶解。