发布时间:2022/07/11 点击数:
发布时间:2022/07/11 点击数:背景
肝脏是最易受药物毒性和药物性肝损伤(DILI)影响的器官之一。DILI是药物消耗的主要原因,已知超过750种FDA批准的药物具有一定程度的DILI风险[1]。在药物研发中,有许多降低DILI风险的策略,近年来,人们的注意力转向了人体体外3D肝脏模型,以更好地在早期和临床前预测DILI[2]。这些模型在生理相关的环境中培养原代人肝细胞,通常采用共培养的方式,使其能够长时间保持功能。
此文中,我们评估了一种微生理系统(MPS),也称为器官芯片(OOC),其体外肝脏模型是否可用于了解肝脏毒性的详细机制方面。MPS先前已被证明可在液流状态下维持高度功能性的3D肝脏微组织长达4周[3],这可能使其非常适合评估DILI。我们使用了两种抗糖尿病的噻唑烷二酮类药物,曲格列酮(获得市场批准,但后来因DILI而退市)和吡格列酮(批准的药物,但已知具备DILI风险)以评估MPS是否可检测急性和慢性毒性。这两种化合物的DILI通常很难使用标准的体外肝脏分析实验和体内临床前模型进行检测[4]。对于每种化合物,进行一系列功能性的肝脏特异性终点(包括临床生物标记物)的浓度反应分析,以生成EC50曲线。对功能性肝脏特异性终点进行分析,以从MPS中创建一个独特的机理的“肝毒性特征”,以证明其评估新型药物的人类DILI风险的能力。
研究目的
1.展示MPS平台生成已知毒物曲格列酮六个毒理学终点 EC50 曲线的能力。
2.证明MPS平台可以检测轻度毒物吡格列酮的DILI反应。
3.演示使用多终点分析如何生成肝毒性特征。
材料和方法
种板:
冷冻保存的原代人肝细胞(PHH)来自BioIVT (欧洲)。实验开始前一天在PhysioMimix OOC MPS-LC12 板(CN Bio Innovations)中种植0.6 x 106 PHH于种板培养基 (William's E Medium, 3.6% Cocktail A, 5% FBS, 1 μM Dexamethasone)中。Day 1更换维持培养基 (William's E Medium, 4% Cocktail B and 1 μM Dexamethasone),细胞在PhysioMimix平台培养2周。
给药:
Day4,在含有0.1% DMSO的WEM维持培养基中以7种浓度给药每种化合物,每48小时给药一次,持续8天。空白对照为含有0.1%DMSO的WEM维持培养基。给药和对照的孔在整个平板上随机分配,每个条件测试三次。化合物采购自Tocris Bioscience公司。
分析:
白蛋白(albumin)的产生通过ELISA(R&D systems)进行测量,LDH的释放通过Cyto-tox96分析(Promega)进行定量,尿素(urea)合成使用QuantiChrom 试剂盒定量,使用P450 Glo CYP3A4试剂盒测定CYP3A4活性(Promega),用丙氨酸转氨酶活性测定试剂盒(Abcam)测定ALT活性,用CellTiter- Glo 3D细胞活力试剂盒(Promega)测定细胞活力。
结果
图 1 – 肝脏 MPS 模型维持3D人肝微组织
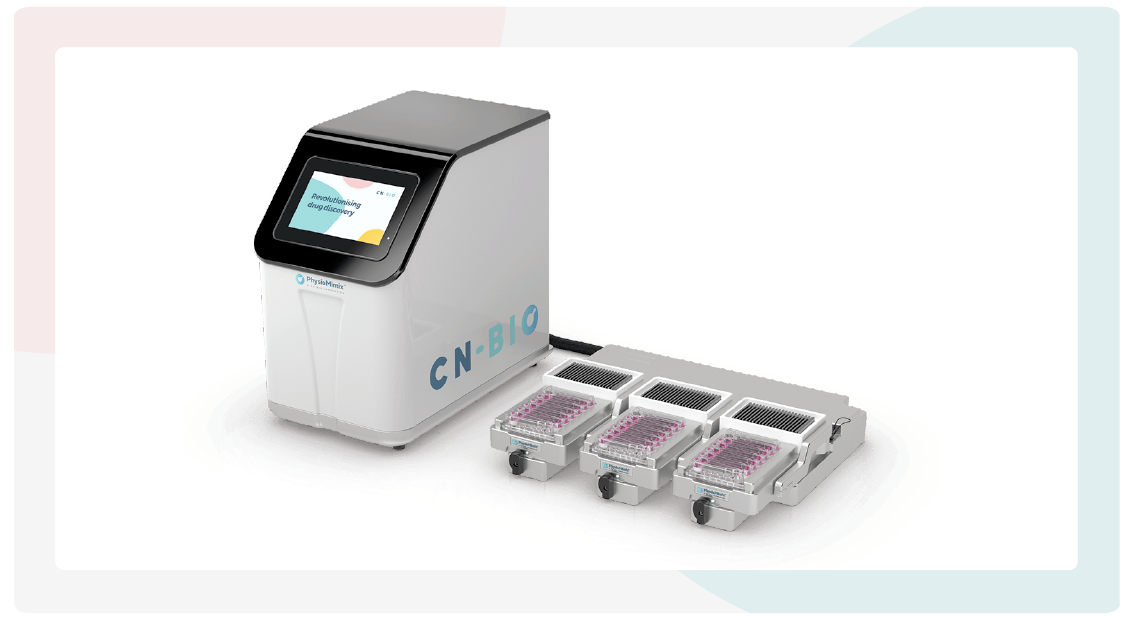
A: 体外模型采用PhysioMimix OOC微生理系统,其使用开放的孔板,设计用于在工程支架中对原代肝细胞进行3D培养。

B: MPS-LC12肝芯片板、支架及其微通道内形成的肝脏3D微组织的示意图。
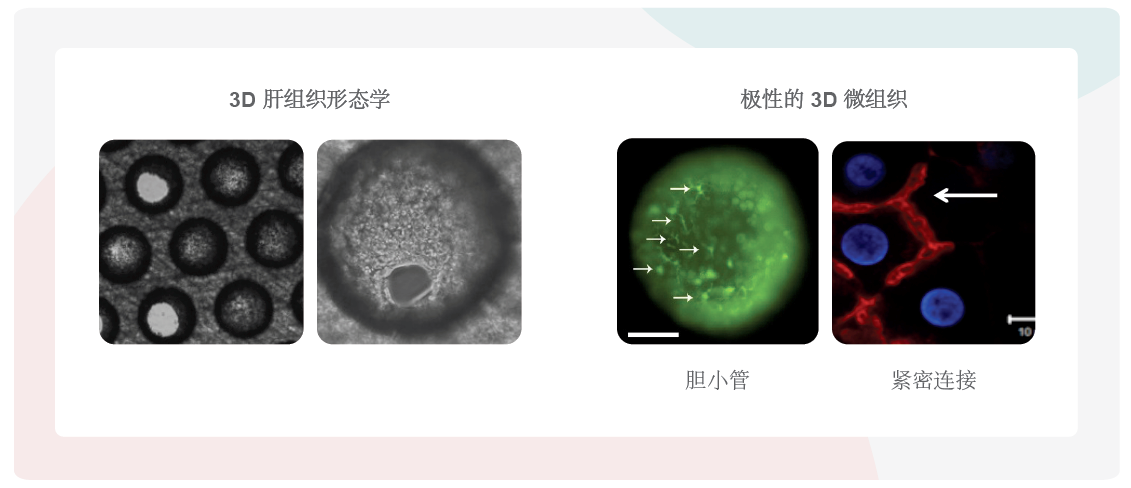
C: 3D极性化肝微组织形成重建了肝脏微结构的证据。
图 2 – 肝MPS产生高度一致性和高度功能化的肝微组织
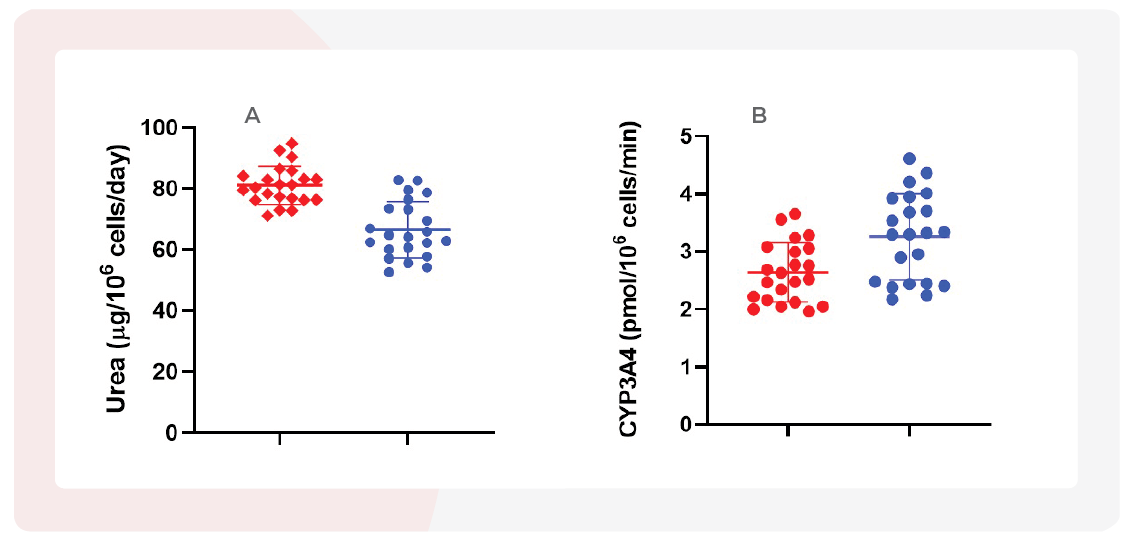
给药前,评估肝脏微组织的 A: 尿素合成和B: CYP3A4酶活性。 红点-使用曲格列酮处理前的组织培养物,蓝点-使用吡格列酮处理前的组织培养物。所示数据包括 mean values ± SD (N=24)。尿素QC合格范围 = 40~100 ug/106 cells/day. CYP3A QC 合规范围= 1~5 pmol/106 cells/day。
图 3 – 急性和慢性暴露于曲格列酮后测定多个肝毒性终点指标的EC50浓度
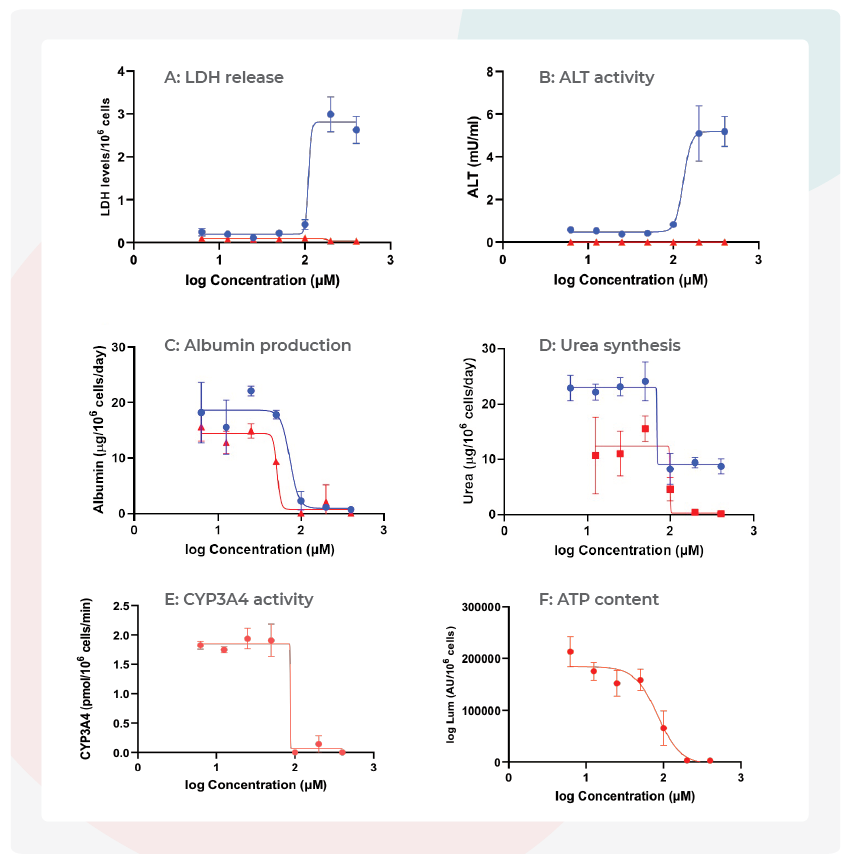
分析暴露于化合物中的肝脏微组织的 A: LDH释放;B: ALT释放;C: Albumin产生;D: Urea合成;E: CYP3A4活性;F: ATP含量。蓝线-急性暴露(48小时),红线-慢性暴露(192小时)。从相同的肝脏MPS培养物中测量所有终点。所示数据为 mean± SD,N=3。
图 4–在微组织接触曲格列酮和吡格列酮后测量肝脏生物标志物随时间的变化显示急性和慢性毒性效应
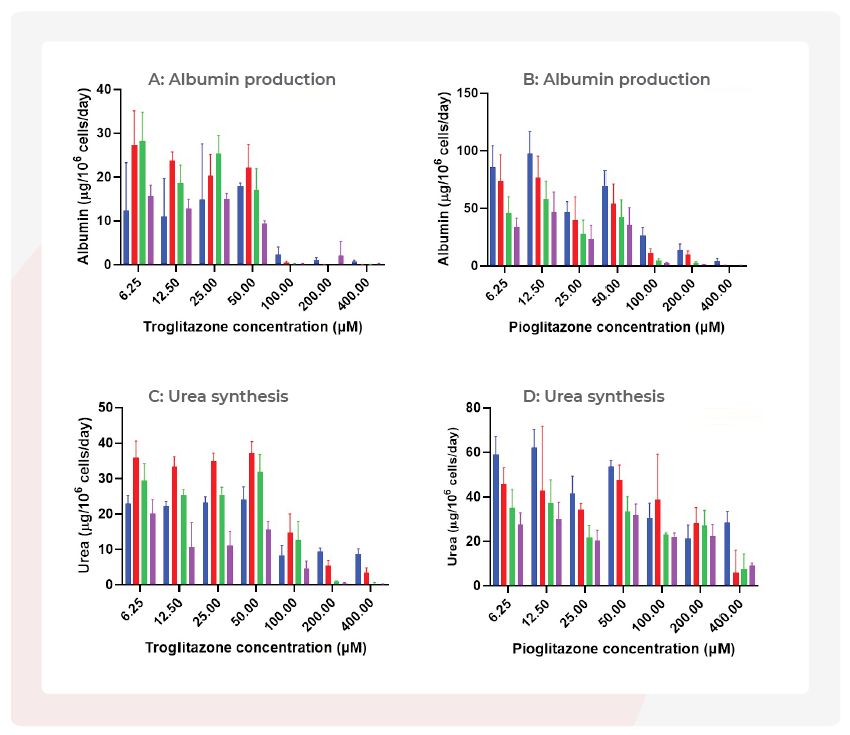
肝脏微组织暴露于曲格列酮和吡格列酮48小时(蓝色)、96小时(红色)、144小时(绿色)和192小时(紫色)。细胞培养基每48小时更新一次,并分析白蛋白和尿素合成。数据显示为 mean± SD,N=3。
表 1‒ 肝脏微组织检测曲格列酮和吡格列酮的毒性
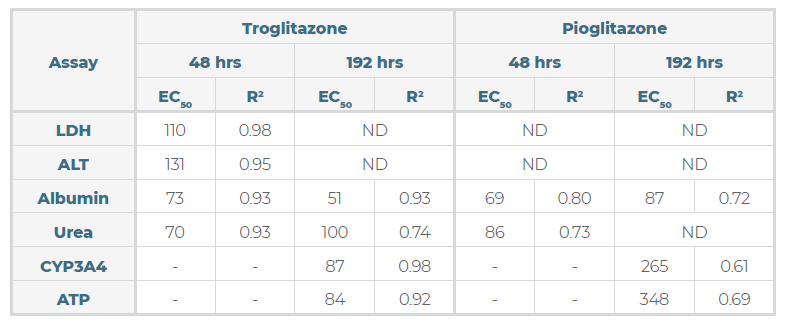
肝脏微组织暴露于这两种化合物48小时或192小时。 ND=数据不可绘制为 EC:50 曲线。横线=未分析。所示数据来自七个剂量反应,每浓度N=3。
结论
采用肝脏MPS模型研究曲格列酮和吡格列酮的急性和慢性暴露。细胞功能和细胞健康终点被用来创建一个独特的机理性“肝毒性特征”图谱,并证明MPS预测DILI风险的能力。将ALT(一种常规测量的临床标志物)纳入终点小组,可以在体外数据和体内结果之间进行直接比较。
曲格列酮引起明显的急性毒性反应,Cmax驱动,在15倍Cmax附近测到ALT和LDH释放以及白蛋白和尿素产量的快速降低。细胞终点(CYP活性和ATP含量)进一步证实了曲格列酮的毒性,从所有分析中得出了高度可比的 EC50 值。该数据反映了其他高级3D体外模型的数据,这些模型也报告了曲格列酮相似的 EC50 值,其表现优于标准体外PHH培养(在这些培养中未无法检测到这种DILI诱导剂[4])。
对吡格列酮的急性和慢性毒性效应都进行了检测。没有检测到LDH或者ALT释放,然而,在48小时后,检测到在大约25倍Cmax附近,白蛋白和尿素的轻度减少。对白蛋白的影响持续了192小时,而在吡格列酮高浓度(约100倍Cmax)下观察到CYP活性和ATP含量的降低。总之,这些结果证明了肝脏MPS具有检测轻度DILI问题化合物毒性的能力。这优于未观察到吡格列酮毒性的其他先进体外肝脏模型[4]。
这些数据证明了测量一系列终点以产生“肝毒性特征”图谱的价值,因为通过这样做,可以识别具有不同DILI问题的药物(包括其他体外方法无法检测到的化合物),并揭示这种毒性的机制。通过将这种肝脏MPS模型纳入药物开发工作流程,它将使人们更好地理解DILI的机制,并通过在开发过程的早期(临床试验开始之前)识别具有人类特异性DILI问题的化合物,帮助减少药物消耗。
1. Thakkar,S. et al. The Liver Toxicity Knowledge Base (LKTB) and drug-induced liver injury (DILI) classification for assessment of human liver injury. Expert Review of Gastroenterology and Hepatology vol. 12 31–38(2018).
2. Weaver, R. J. et al. Managing the challenge of drug-induced liver injury: a road map for the development and deployment of preclinical predictive models. Nat.Rev. Drug Discov. 19, 131–148 (2020).
3. Rowe, C. et al. Perfused human hepatocyte microtissues identify reactive metabolite-forming and mitochondria-perturbing hepatotoxins. Toxicol.Vitr. 46, 29–38 (2018).
4. Proctor, W. R. et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Arch. Toxicol. 91, 2849–
关于CN-Bio PhysioMimix
CN Bio的器官芯片系统,包括PhysioMimix实验室台式仪器,使研究人员能够通过快速、且具有预测性的、基于人体组织的研究,在实验室中对人体生物学进行建模。该技术弥补了传统细胞培养与人体研究之间的鸿沟,朝着模拟人体生物学微环境的方向前进,以支持加速开发包括肿瘤学,传染病,新陈代谢和炎症在内的应用领域的新疗法。
CN Bio PhysioMimix 系列包括T1和M1两款微流控器官芯片系统,分别驱动单器官芯片模型和多器官芯片模型。每套系统标准配置包括:
1)一台置于细胞培养箱外部的控制器;
2)一台置于二氧化碳培养箱中的扩展底座;
3)以及对应的三套微流控芯片板驱动器。

目前已经开发成熟的应用是在CN-Bio的单器官微流控芯片板LC12和T12,以及双器官微流控芯片板TL6上实现的。

参考文献
Disease Modelling/疾病模型
· [Infectious disease] Ortega-Prieto AM et al. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection. Nat Commun. 2018 Feb; 9:pp-pp.
· [Diabetes and NASH] Kostrzewski T et al.Three-dimensional perfused human in vitro model of non-alcoholic fatty liver disease. World J Gastroenterol 2017; 23(2): 204-215
· [Oncology] Wheeler SE et al. Spontaneous dormancy of metastatic breast cancer cells in an all human liver microphysiologic system. Br J Cancer 2014; 111(12): 2342-2350
Multi-Organ Systems/多器官系统
· [2-Organs] Chen WL et al. Integrated Gut/ Liver Microphysiological Systems Elucidates Inflammatory Inter-Tissue Crosstalk. Biotechnology and Bioengineering, 2017;114 (11): 2648-2659
· [2-Organs] Dalrymple A et al. The characterisation of a human two Organ-ona-Chip (lung-liver) system which has the potential to measure systemic responses in vitro. Poster presented at Society of Toxicology 57th Annual meeting; 2018 Mar 11-15: San Antonio, Texas.
· [4/7/10-Organs] Edington et al. Interconnected Microphysiological Systems for Quantitative Biology and Pharmacology Studies. Sci Rep, 2018. IN PRESS
Drug Discovery/药物研发
· [Drug Safety] Long TJ et al. Modeling Therapeutic Antibody-Small Molecule Drug-Drug Interactions Using a Three-Dimensional Perfusable Human Liver Coculture Platform. Drug Metab Dispos 2016; 44(12): 1940-1948
· [Drug Metabolism] Vivares A et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica 2015; 45(1): 29-44
· [Drug Metabolism] Tsamandouras N et al. Quantitative Assessment of Population Variability in Hepatic Drug Metabolism Using a Perfused Three-Dimensional Human Liver Microphysiological System. J Pharmacol Exp Ther 2017; 360(1): 95-105