发布时间:2022/05/16 点击数:
发布时间:2022/05/16 点击数:生物制药占全球药品销售额的很大一部分,2019年全球十大药物重磅炸弹中有八个是重组生物制药。为确保高水平的临床试验期间的患者安全和药品放行,不同的监管机构制定了许多法规,例如FDA和EMA。药品的市场准入上市申请需要对潜在风险和收益、关键质量属性 (CQA) 进行深入的全面评估,这些属性包含在通用技术文件 (CTD) 中。其中,宿主细胞蛋白 (HCP) 就是这样一种 CQA。它们形成具有不同理化和免疫特性的蛋白质的复杂混合物,并且是在生物制品制造过程中由生产细胞系释放。
复杂细胞生产系统的 HCP 形成受多种生物和非生物因素的影响,很难预测单个制造过程的 HCP 表现模式。因此 HCP 被定义为与工艺相关的药物杂质,会对生物药物产品的质量、安全性和功效产生负面影响,对患者具有潜在风险,因为它们可能在人体内表现出免疫原性或其他不希望的活性。在纯化过程中,必须有效降低HCPs,以确保去除最终原料药中不需要的HCP蛋白质。
EMA 和 FDA 这两个主要监管机构发布了一套指导方针,以监管生产过程中对 HCP 的控制。这些指南的要点是:
• 建议采用高度敏感的方法
• 需要定期检测残留 HCP
• 要求最终原料药中 HCP 残留允许量为 (<1-100 ppm)
特别是 ICH 指南 Q6B、Q8(R2)、和 Q11 定义了此类杂质,并明确了在逐步下游加工过程 (DSP) 中精确监测和减少 HCP 的需求,一直到很低的含量。尽管没有指定精确值,但普遍的共识是将最终原料药中的 HCP 负担降低到100 ppm 以下和 10 ng/剂以下。
准确检测后续 DSP 样品直至最终原料药中的 HCP 杂质在很大程度上取决于建立可靠且稳健的 HCP 测量方法。为了克服对于 HCP 定量的个别方法的内在局限性,建议使用多方面的 HCP 分析方法。目前,有一系列方法可用于监测药物生产过程中HCP的下降。但因酶联免疫吸附试验 (ELISA) 方法具有高速、高灵敏度和高通量相结合的优点,且无需高成本的仪器,因此仍然被认为是 HCP 检测的金标准。
对 HCP 监控的需求和 HCP ELISA 的选择思考
监管机构已就使用不同的宿主细胞蛋白酶联免疫吸附测定 (HCP ELISA) 形式检测 HCP提出了一致的建议。根据生物制品的开发阶段,用于 HCP 定量的 HCP ELISA 可分为三种主要形式(如下图):
1)通用型 HCP ELISA 试剂盒,也即商业化的 HCP 试剂盒;
2)工艺平台(或多产品)型 HCP ELISA,也即根据具体工艺流程/平台定制的 ELISA方法和配套的试剂;
3)工艺特定型 HCP ELISA,以及单独为某一种药物特定的工艺开发的 ELISA 方法和配套的试剂。

用于 HCP 定量的三种 ELISA 方法
HCP ELISA 的适用性通常由性能标准决定,例如:即使在高度纯化的样品中也能检测 HCP 痕量的检测方法的灵敏度,以证明下游工艺过程 (DSP) 中的 HCP 对数降低、严格的稀释线性和足够的 HCP 抗原特异性抗体覆盖率。虽然商业化的通用型 HCP ELISA 使用广泛活性的抗体覆盖方法,但该方法仅针对重组蛋白生产的选定细胞系种类,后两种 HCP ELISA 形式基于对特定生物制药的制造和加工提供更高的特异性。
对于在候选药物开发的不同阶段最好使用哪种 HCP ELISA 方法,这并无法给出一个很明确的答案。如图所示,在临床试验的 I 期和 II 期期间仍可能发生 DSP 开发的变化。后者的完成(II期)则需要为高度稳健性的工艺定义工艺参数规范。相比之下,用于临床 III 期试验的原料药必须满足与上市后连续生产药物相同的要求。对于这一阶段(III期)的药物生产,所有过程都需要进行验证,包括分析方法的使用。如果在此阶段(III期)对生产过程进行更改,则必须重复工艺验证,直到达到足够的一致性。这包括监测残留的 HCP 杂质,当在生产或 DSP 过程中引入变化时,这些杂质的数量和成分在技术上会有所不同。
因此,最常见的建议是在方法开发过程中仅依赖广泛有效的通用型 HCP ELISA 试剂盒(II期前)。在向 II 期和 III 期扩展临床试验申请前进时,工艺特定的 HCP ELISA 的实施通常证明足以用于 HCP 监测,从而满足测定验证的标准。在生产和 DSP 条件以及不同生物制品药物的主要性质差异很小,没有对相应的 HCP 表现模式产生很大影响的情况下,使用平台(多产品)型 HCP ELISA 就足够了。

不同阶段使用的不同HCP检测策略
综上所述,平台型或工艺特定的 HCP 检测让您高枕无忧。然而,由于药物失败的高风险,此类检测仅在开发的后期阶段才值得投资。本篇接下来将重点介绍商业化通用型CHO HCP ELISA试剂盒,近期将另撰写文章介绍定制化的平台型或工艺特异型的 HCP ELISA 开发策略。
如何选择最合适的HCP ELISA检测试剂盒?
从理论上讲,通用型HCP ELISA试剂盒应适用于特定细胞系的所有HCP测定,不受细胞系改造、发酵条件和纯化工艺设计的影响。但在大多数情况下,根据细胞系、培养基和工艺参数的不同,HCP的污染物可能会有很大差异。 HCP 试剂盒对所有 HCP 的识别程度将取决于其配套的抗体与实际 样本中HCP 组成的匹配程度,以及针对不同HCP的抗体丰度和对相应的 HCP 的亲和力。因此,各种商业化通用型 HCP ELISA 在检测相似类型和水平的 HCPs 的能力方面可能存在很大差异。并非所有的商业化通用型HCP ELISA试剂盒能在每个项目中均显示出所需的特异性和敏感性。
解决方案--增强的通用型HCP ELISA试剂盒组合套装
德国有名的生物技术公司 BioGenes 已经开发出一种增强的通用 CHO 360-HCP 分析方法,明显优于当前的其他商业化通用型 HCP ELISA 试剂盒。
自1999年以来,BioGenes 已开发出多种 HCP ELISA 试剂盒和方法,包括通用型,平台型和工艺特异型。在使用不同细胞系完成了150多个项目后,BioGenes 已在 HCP 残留检测领域打下了深厚的基础,积累了宝贵的定制开发与协助申报的能力。在经验丰富的科学家和积极主动的项目管理团队的支持下,BioGenes 具备提供多方位服务的能力,受到全球客户的赞赏。
Biogenes 目前的通用型 HCP ELISA 产品主要包括针对 CHO 和 E.coli 宿主开发的试剂盒。以下以 CHO 相关产品举例。
1、CHO|360-HCP ELISA 的抗体和检测方法开发
多克隆 HCP 抗血清是通过用等量的源自模拟转染和发酵的中国仓鼠卵巢(CHO)细胞系的CHO K1 和 CHO S 细胞的 HCP 对兔子和山羊进行免疫而产生的。使用不同制备的抗原:1)总 HCP ,或2)分子量分级 HCP(下表),每个HCP级分(低分子量、中分子量和高分子量)单独用于免疫,在纯化前汇集不同 HCP 级分的抗血清,通过使用针对总 HCP 的优化纯化策略获得单特异性多克隆抗体。这产生了一组四种不同的 HCP ELISA试剂盒(A ~ D型),它们共同构建了增强型通用 CHO|360-HCPELISA 试剂盒组合套装。
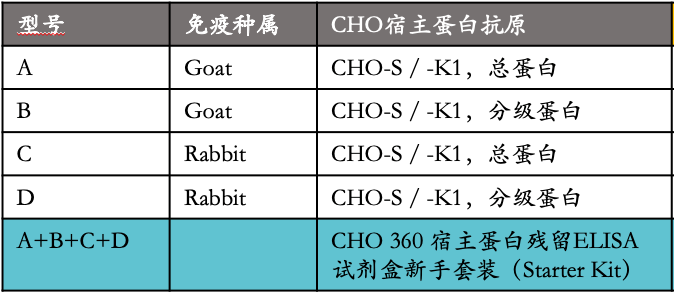
2、检测特异性
通过 CHO-HCP 标准品的二维 (2D) 凝胶电泳和相应的 A~D 型试剂盒的抗体进行免疫印迹,确定了所有四种测定对抗原的高特异性(图 1)。作为参考,将 HCP 的 2D凝胶电泳蛋白质图谱转移到硝酸纤维素膜上并用胶体金染色(图 2)
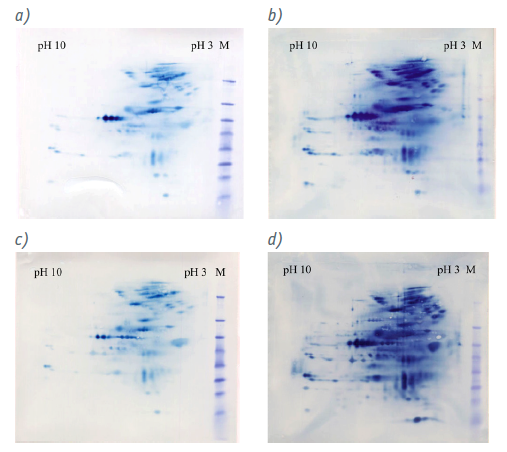
图1:显示 Biogene CHO 360-HCP 的抗体特异性,分别使用 A~D 型试剂盒抗体对经过2D 凝胶电泳的 CHO-HCP 标准品进行免疫印迹杂交
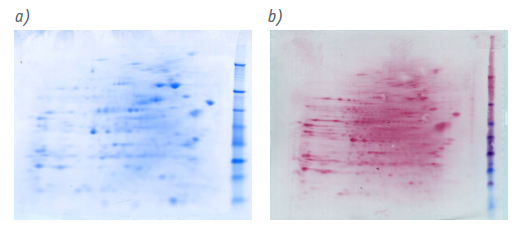
图2:显示了 CHO-HCP 的总蛋白分布。a)CHO-HCP 标准品在 2D 凝胶电泳后的考马斯染色;b)凝胶电泳印迹到硝酸纤维素膜后的胶体金染色
3、灵敏度
通过对 CHO-HCP 抗原进行考马斯染色,并用相应抗体进行 2D Western 印迹,确定了在所有四种检测中对抗原的高度特异性。对于所有四种试剂盒,检测下限(LOD)在0.5~1.0 ng/mL之间,定量下限(LOQ)为 2~3 ng/mL,工作范围 2~100 ng/mL。
4、回收率
CHO 360-HCP 试验旨在覆盖广泛的抗原,CHO|360-HCP ELISA 已在大量模拟 CHO-HCP 样本的基础上进行了广泛测试。所有样品均来自对应于某些生物制品生产过程的 CHO 细胞的模拟发酵。对于每个 HCP 样品,蛋白总量首先由 Bradford 确定。此外,每个样品都使用五种不同的 CHO-HCP 测定法进行分析:BioGenes 通用 CHO|360-HCP ELISA 类型 A ~D 和常用的一款商业化通用 CHO-HCP 测定法。
如下图,在样品 4 (x) 的情况下,使用类型 D回收率为测定估计为>90%。使用类型 A~C试剂盒的回收率要低得多,而使用那款商业化试剂盒测定的回收率仅为 20%。在大多数情况下(>65%),可用我们的四种通用 CHO|360-HCP ELISA(A ~ D 型)中的一种估计最佳的回收率。
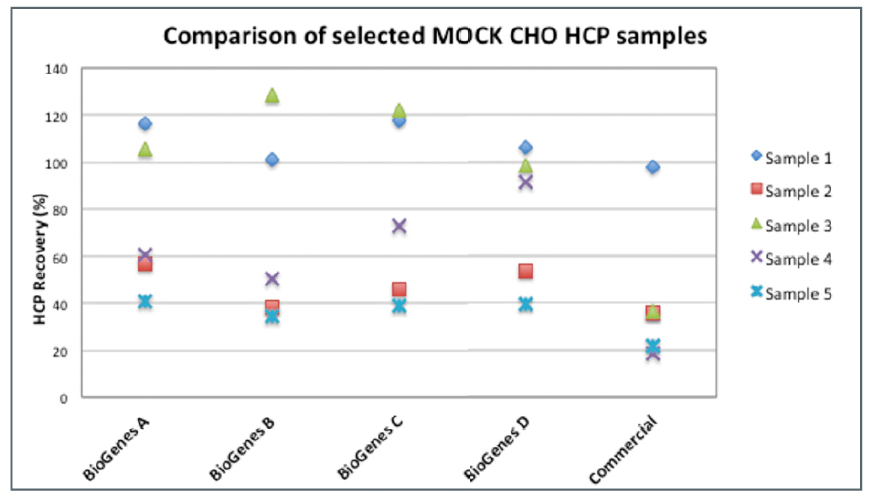
不同HCP ELISA试剂盒在不同样品中的回收率表现
产品特色和优点
Biogenes的通用型 360-HCP ELISA试剂盒提供了A~D型四种选择(每种试剂盒使用不同的抗体组)。Starter Set入门套装(A~D型试剂盒各一套)可以快速轻松地选择最合适的其中一种。另外,使用360-HCP ELISA 检测试剂盒的优势如下所述:
• 更少的非特异性结合: 360-HCP ELISA 试剂盒使用链霉亲和素-POD 偶联物用于检测生物素标记的抗体,以获得可重复的结果、更少的非特异性结合和更低的背景噪音
• 即使用最高稀释度的标准品也能得到准确的结果:360-HCP ELISA 试剂盒提供未稀释的标准品以获得更高的产品稳定性、更准确的结果以及设置稀释范围的更大灵活性
• 自动洗板:可在自动洗板机和高通量系统中使用 360-HCP ELISA 试剂盒,建议在孵育期间振荡混匀
总结
根据Biogenes的数据和长期经验得出结论,没有一种通用的HCP检测方法适用于所有样本。 然而,在Biogenes的CHO 360-HCP分析中,通过A~D型四种不同试剂盒的组合,以及伴随的 2D 分析测试各个过程的模拟 CHO-HCP 以及多个过程控制样品(ICP)来确定,这种前期可行性测试可大大提高大多数样品的回收率。
为了选择性能最佳的试剂盒类型,使用 Starter Set 入门试剂盒套装对3~5个过程中样品在八个稀释度(2倍梯度稀释系列)和重复孔中进行分析。
下图显示了选择最佳检测试剂盒的一般流程。
首先,选择产生最高 HCP 信号的试剂盒类型。
其次,在下游纯化过程中,测得的HCP 水平应随着工艺进程明显降低。如果它们保持不变或仅略有下降,则可能是抗体与重组产物(DS药物)的交叉反应。在这种情况下,建议进行额外的测试,例如 1D 或 2D 免疫印迹。
最后,选择具有可接受的稀释线性的试剂盒类型,样品的不同稀释度应该存在稀释线性。
我们建议选择显示最高 HCP 值和可接受的稀释线性的试剂盒类型。如果试剂盒类型显示最高 HCP 值但没有或呈现不可接受的稀释线性,建议选择显示最佳稀释线性但 HCP 值较低的试剂盒类型。
如果四种试剂盒类型均不符合选择标准,则可能建议开发平台型或特定工艺过程的 HCP 检测 ELISA 方法。其他分析,例如使用 Mock HCP 和选定的抗 HCP 抗体进行的 2D 免疫印迹以及加标实验,可以帮助进一步评估 ELISA 方法的准确性。
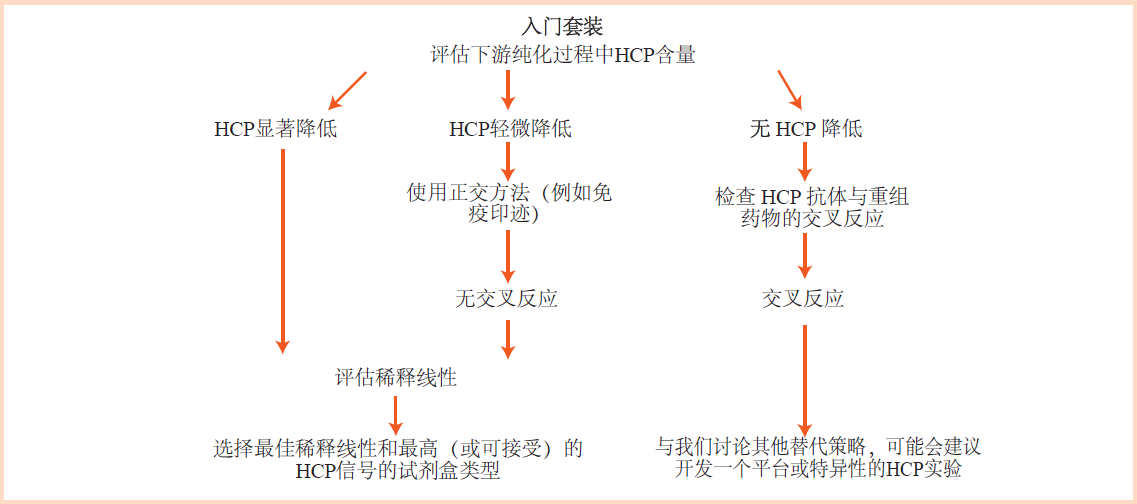
选择最佳 CHO 360-HCP ELISA 试剂盒类型的一般流程