发布时间:2023/09/22 点击数:
发布时间:2023/09/22 点击数:Roche通过CN-Bio的PhysioMimix MPS多器官系统
研究霉酚酸酯的体外药代动力学
本文概述
这项研究使用多器官芯片系统(包括肠道和肝脏模型),来研究霉酚酸酯(MM)及其两个主要代谢物(MPA、MPAG)的药代动力学,为未来深入探讨肠道和肝脏如何共同影响药物及其代谢物暴露的影响提供了新的可能性。
研究背景
药物代谢是指一个药物在结构上被修饰,以形成代谢物的复杂过程。对于一个新药,需要研究药物代谢和药代动力学 (DMPK),以确定具有PK/PD 特性的Top先导化合物,从而优化疗效,并尽可能地减少安全问题。
药物代谢研究现状如下:
当前研究药物代谢的技术局限性
✘ 低清除的药物无法使用悬浮肝细胞评估
✘ 许多系统不能展示足够的II期代谢
✘ 代谢在液流“单向流动”的OOC和球体模型中无法测量代谢
✘ 一些器官芯片技术不适用,因为它们使用了聚二甲基硅氧烷(PDMS),该材料会吸收药物
PhysioMimix的进步性
· 长时间的代谢能力意味着可以评估低清除的药物
· 肝脏芯片提供I期、II期和III期代谢
· 我们的模型具有优化的细胞与培养基的比例,确保新陈代谢可测量
· 我们的系统采用低结合非硅材料制成
· 肝脏芯片模型通常含有50万细胞,为检测罕见代谢物提供了足够的"动力"
这里我们介绍一个研究例子:来自Roche的研究团队应用CN-Bio的PhysioMimix MPS 多器官系统,定量地研究霉酚酸酯的体外药代动力学。在过去几年,已经有几个研究团队评估了CN-Bio的肠肝双器官系统中,肠道腔室作为屏障组织的作用,使用的药物有双氯芬酸、氢化可的松、三唑仑等,但未使用主要在肠道中代谢的药物,因此本研究中来自罗氏的研究团队,选取了霉酚酸酯作为主要的研究对象。
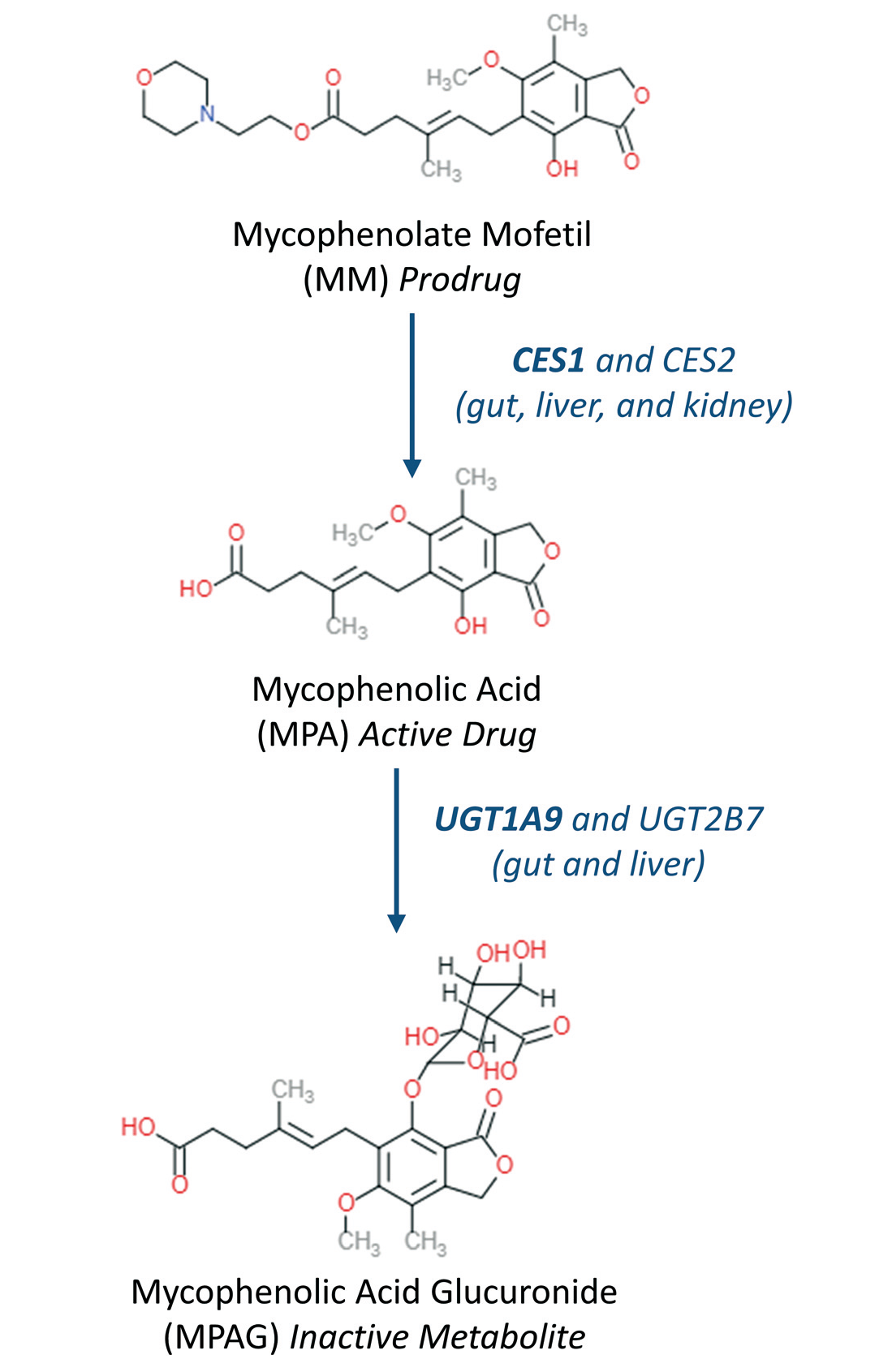
霉酚酸酯在体内转化的过程如图1,霉酚酸酯作为前药MM,在肠、肝、肾内转化为活性药物MPA,然后在肠和肝中继续代谢为无活性的MPAG。肠道细胞Caco2和HT29表达的CES、UGT1A9和UGT2B7等酶参与MPA的葡萄糖化代谢。
Fig.1 霉酚酸酯活化和进一步代谢的主要代谢步骤和参与代谢转化的主要器官和酶。
研究过程
下图展示的是Roche的研究团队使用CN-Bio的多器官系统以及肠-肝MPS-TL6耗材板(图2)。
该板与CN Bio的PhysioMimix多器官实验室台式仪器兼容,由六个孔组成,每个孔有两个腔室,一个Transwell屏障模型,一个肝脏模型(图 2-A)。液体流速可以在每个腔室,以及从肝脏腔室到transwell屏障腔室中互连通道中,独立控制。肠道屏障模型是由肠上皮细胞和杯状细胞混合培养在一个通透的Transwell 薄膜上(图 2-B)。三种实验系统的腔室、培养基体积和流速以及采样点如图所示(图 2-C)。
Fig.2 PhysioMimix 肝-肠 MPS 展示
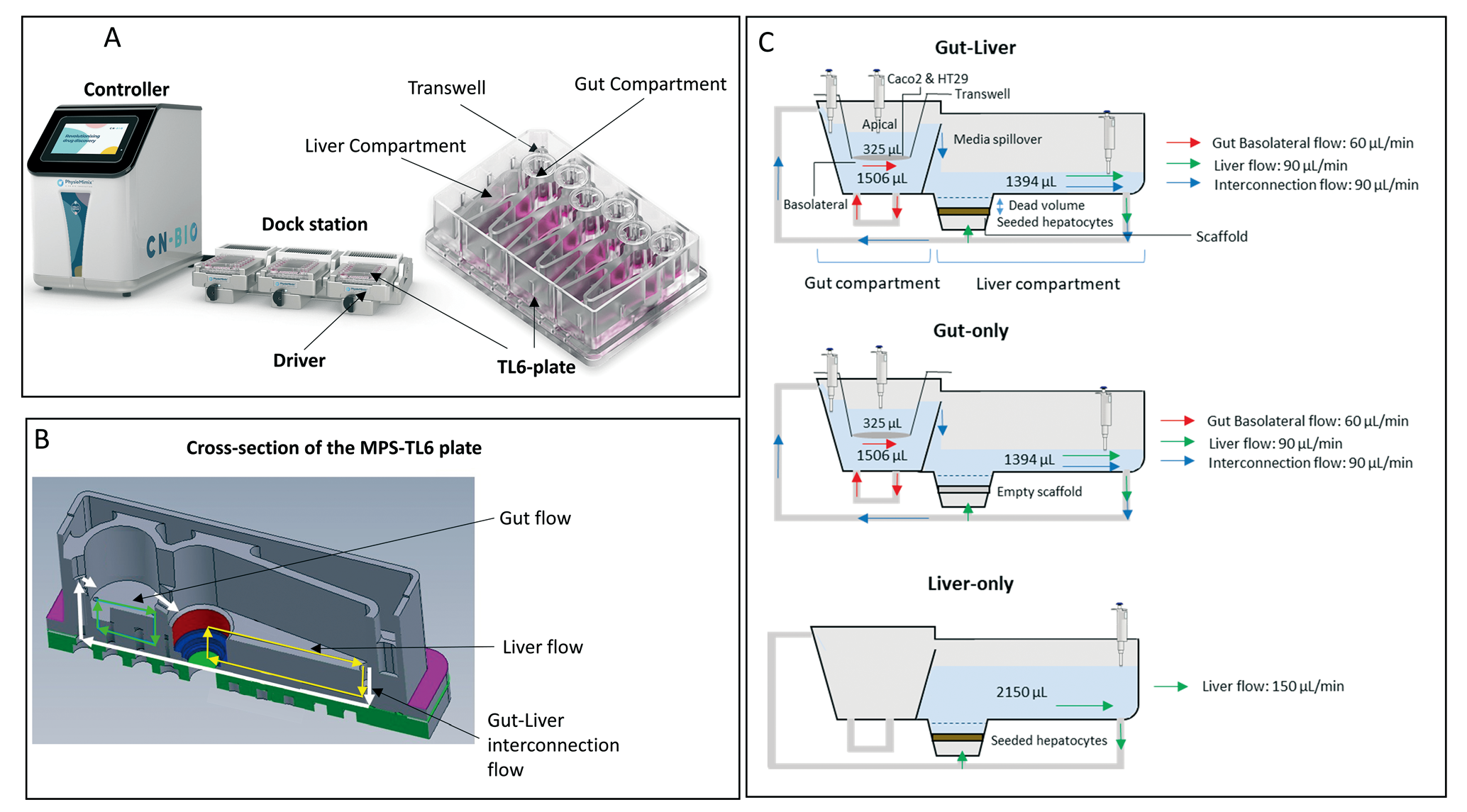
这三种实验系统分别是:肠-肝共培养、仅肠道(无PHH肝实质细胞)和仅肝脏(无肠道屏障,将药物注入无细胞的空白Transwell)
(1)在肠-肝共培养实验开始时,肠顶端隔室中的肠道组织,由结肠癌Caco2和HT29细胞共同培养,两种细胞具有屏障和代谢功能。HT29细胞是能产生粘液的肠细胞,提供了额外的扩散屏障作用。共培养的目的是为了更好地再现小肠的屏障功能,使肠的通透性和代谢更加相关;在整个孵育过程中,互联流量、基底流量和肝脏隔室流量分别设置为90、60和90微升/分钟,整个过程中的蒸发量因技术原因无法测量,但在数据分析中,会根据前人研究加以考虑。
(2)仅肠实验,与肠肝共培养实验的wei yi区别,就是肝脏腔室中没有加入细胞。
(3)仅肝实验中,不使用肠腔室,流速提升为 150 微升/分钟。
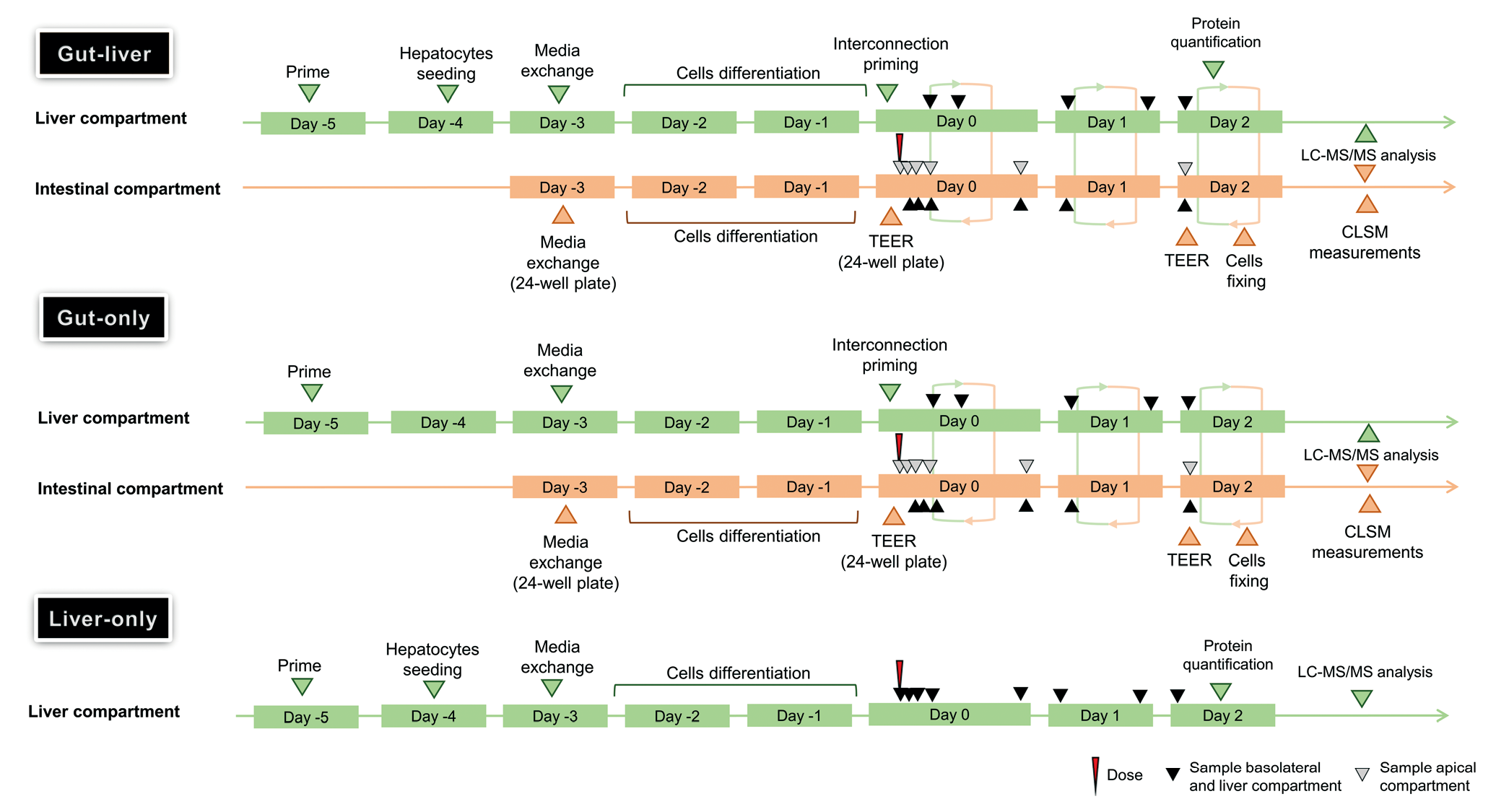
不同隔室的采样时间、板的准备和孵育、肝蛋白质总量和TEER的测量示意图如表1和图3所示。
表1和图3是在三种实验系统中评估霉酚酸酯的肠道-肝脏 OoC 实验的初始药物浓度、各部分体积、流速,以及采样点时间轴和主要事件。
Table 1 实验的初始药物浓度、各部分体积、流速,以及采样点。
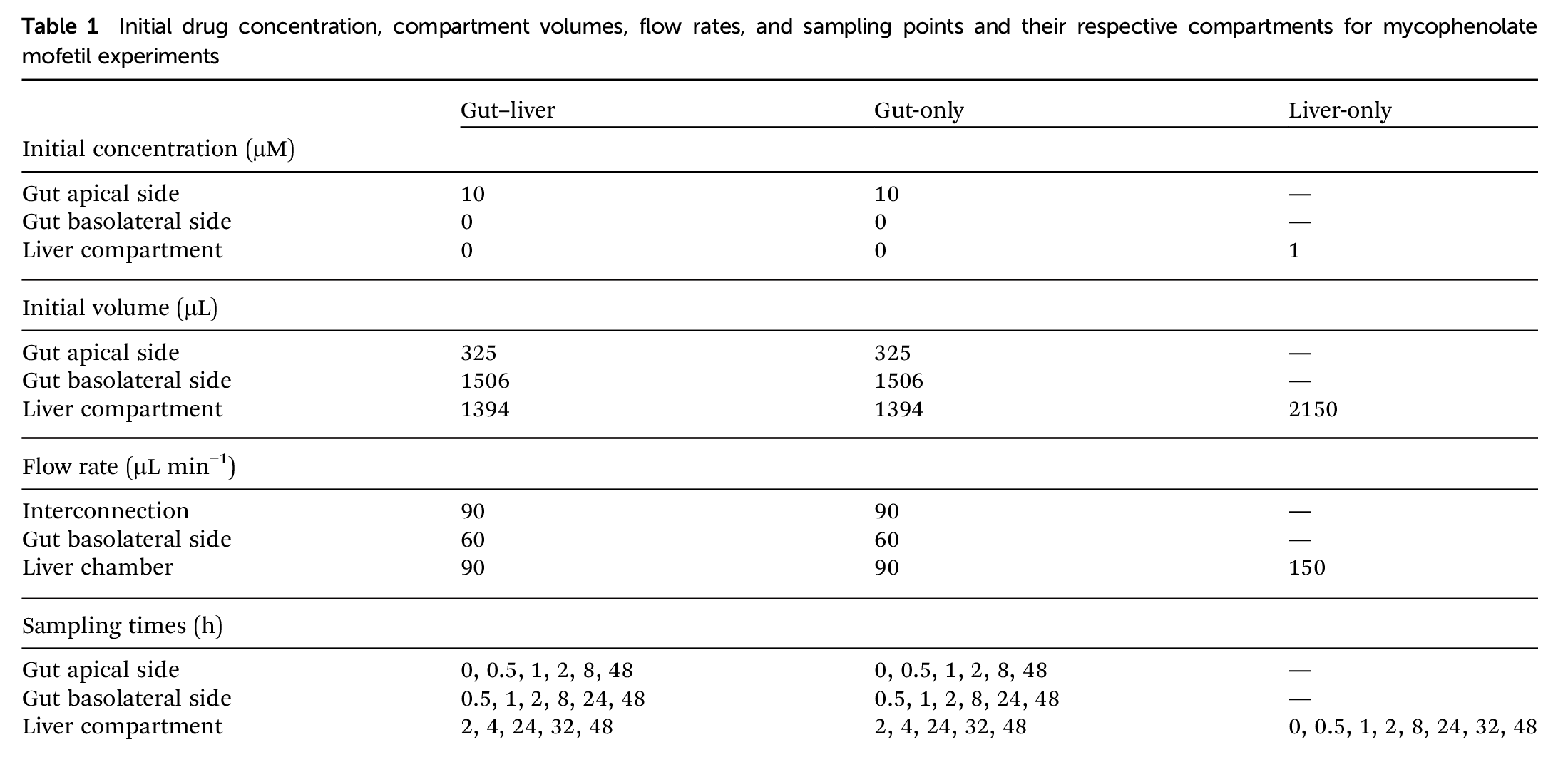
Fig.3 在三种实验系统中评估霉酚酸酯的肠道-肝脏 OoC 实验的时间轴和主要事件。
实验结果
下面我们将展示三组系统对原药霉酚酸酯(MM)及其代谢物(MPA 和 MPAG)的时间浓度分析结果,每组系统分别在肠腔室顶侧(Apical)、肠腔室基底侧(Basolateral)和肝腔室取样分析。
在图4中的肠-肝(Gut-Liver)实验体系中,我们可以看到,
Fig.4 肠-肝实验系统组,对原药霉酚酸酯(MM)及其代谢物(MPA和MPAG)的时间浓度进行三重分析
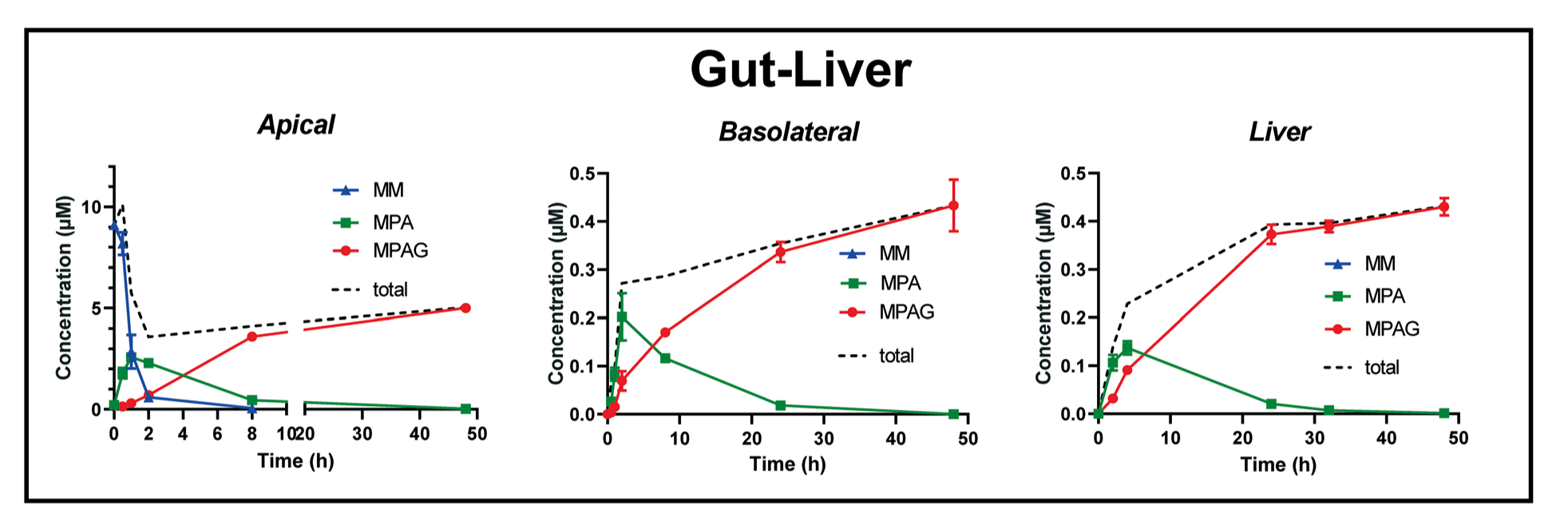
·当将10μM的霉酚酸酯(MM),给予到肠道顶部室时,原药MM浓度迅速降低,而在基底侧没有检测到MM。这表明肠细胞中的代谢酶将MM迅速水解形成活性药物MPA。
·接着,在肠细胞内形成的活性药物MPA穿越肠细胞顶部和肠腔室基底膜,进入体积更大的基底侧以及肝腔室(2900μL)被稀释,从而导致基底室浓度低。
·最初在顶部侧观察到相对较高的MPA浓度,这个浓度在实验开始后不久,大约1小时就达到峰值(∼2.5μM),然后随着药物回流到肠细胞和进入更大的基底室而下降。
·活性药物MPA通过在肠和肝细胞中进行葡萄糖苷化代谢,形成无活性代谢物MPAG,因为MPAG的形成速度,比其从细胞中渗出的速度快,所以在肝-肠细胞中积累,并且在48小时孵化结束时,MPA已经完全转化为MPAG。这与所有培养腔室中,总药物量最初减少,后期孵化时增加的现象一致。
Fig.5 仅肠实验系统组,对原药霉酚酸酯(MM)及其代谢物(MPA 和 MPAG)的时间浓度进行三重分析
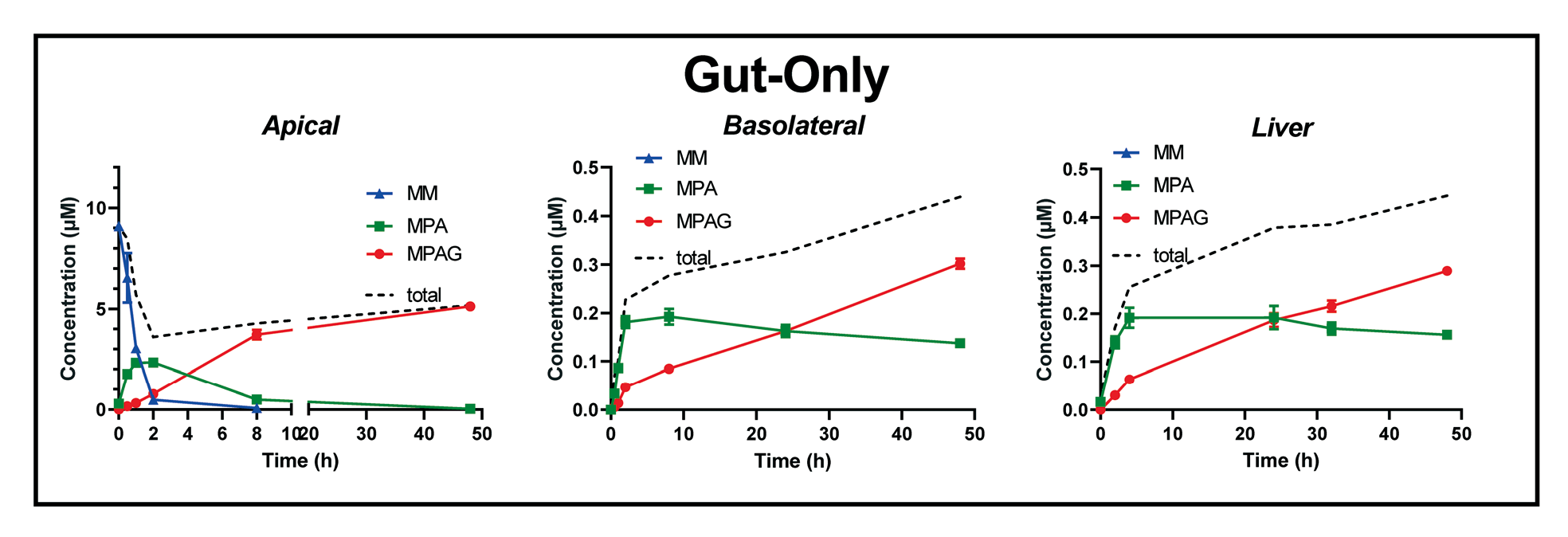
而在单个肠(Gut-Only)体系中,顶侧的MM和MPA的浓度时间曲线,与肝-肠组非常相似,但基底侧和肝腔室曲线不能完全清楚的表明肝对MPA总体代谢的贡献,可以看到,在48小时后,基底侧和肝腔室中,仍然有大约0.2uM的MPA没有被代谢掉,这与肠-肝组的数据以及以往体内的研究报告不完全相符(图5)。
Fig.6 仅肝实验系统组,对原药霉酚酸酯(MM)及其代谢物(MPA 和 MPAG)的时间浓度进行三重分析
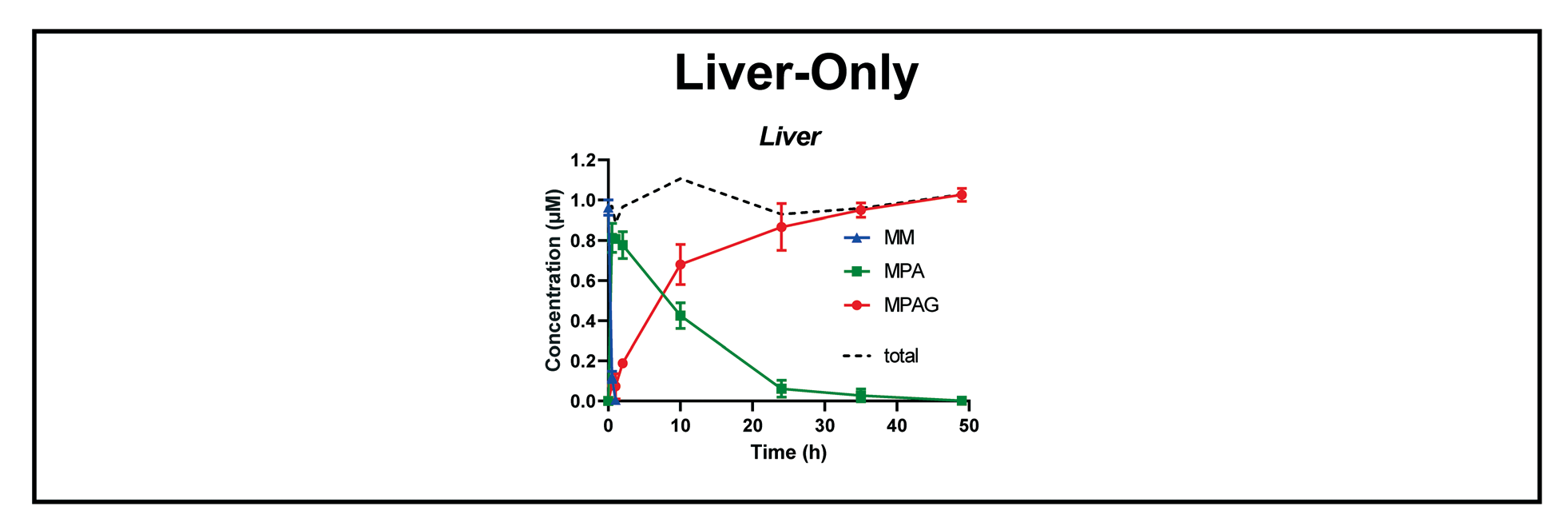
同样,在只有肝(Liver-Only)的实验条件下,由于肝细胞的羧酸酯酶活性非常高,前药MM(以较低浓度(1μM,但总药物量相同))直接给药到肝腔室后,被水解得特别快,1小时内MM的浓度就低于限定值。仅30分钟,活性药物MPA就达到了峰值,48小时后MPA迅速转化为MPAG,这一过程说明肝腔室,在肠-肝腔室代谢MPA中发挥的作用,以及肠道系统中的基底侧和肝脏区域中MPA的相对稳定性(图6)。
结论
以上数据共同证实了,只有在一个器官芯片系统设备中,使肠(Caco2以及HT29)细胞和肝细胞共同培养,才能更完整的定性研究肠和肝对MM、MPA、MPAG的共同贡献。同时,这项工作在前人使用多器官芯片系统的研究基础上,进一步深入探讨了多器官芯片系统用于评估肠道和肝脏代谢和清除功能的应用,以及研究药物相互作用的效用。
本篇软文仅部分展示Roche的研究,全部内容可参考:
[1]Lab Chip, 2022, 22, 2853 DOI: 10.1039/d2lc00276k