发布时间:2023/10/25 点击数:
发布时间:2023/10/25 点击数:将人类小肠与肝脏串联:用于更具预测性的人体药物ADME和口服生物利用度研究的多器官微生理系统(MPS)
本文亮点
美国知名体外模型公司Altis Biosystems利用CN-Bio的肠肝双器官微生理系统(Gut-Liver MPS),模拟了人体口服用药的生理条件,并成功预测两种目前的模型无法充分预测人体ADME行为的药物。

摘要
传统的永生化肠道细胞系和悬浮肝细胞没有代谢酶表达或表达水平很低,因此无法预测人体的首过代谢和口服生物利用度。
为改善药物功效和安全性数据的体外到体内翻译,出现了更具人类相关性的多器官微生理系统(MPS),由多个流体连接的器官组成。在这里,我们描述了一种新的MPS,它使用CN-Bio的多器官系统将空肠(RepliGut planar - jejunum)与肝脏连接起来,而且两种细胞都来自人体原代细胞1。
为了证明其先进的预测能力,我们研究了两种目前的模型无法充分预测人体ADME行为的药物2,3,分别是Temocapril(一种设计成抵抗肠道水解的前药)和Midazolam(咪达唑仑,已知经历肠道清除的药物)。
研究目标
本研究的目标是
- 开发完全由原代人类细胞组成的肠道-肝脏 MPS
- 展示肝脏和肠道组织的功能
- 提供进行药物 ADME 和生物利用度研究的方案
- 在目前的模型无法预测人体 ADME 行为的情况下,用两种药物证明改进的预测能力
材料与方法
01- 肠道-肝脏MPS的建立

图1
图1 a:肠道-肝脏 MPS 是使用 PhysioMimix 多器官系统和双器官板建立的。
图1 b:对于肠屏障,空肠隐窝上皮干细胞在仿生支架上进行扩增和分化,并在静态条件下进行。
图1 c:肝脏微组织是通过在三维胶原涂层支架上播种原代人类肝细胞(PHH)形成的。
02- ADME研究
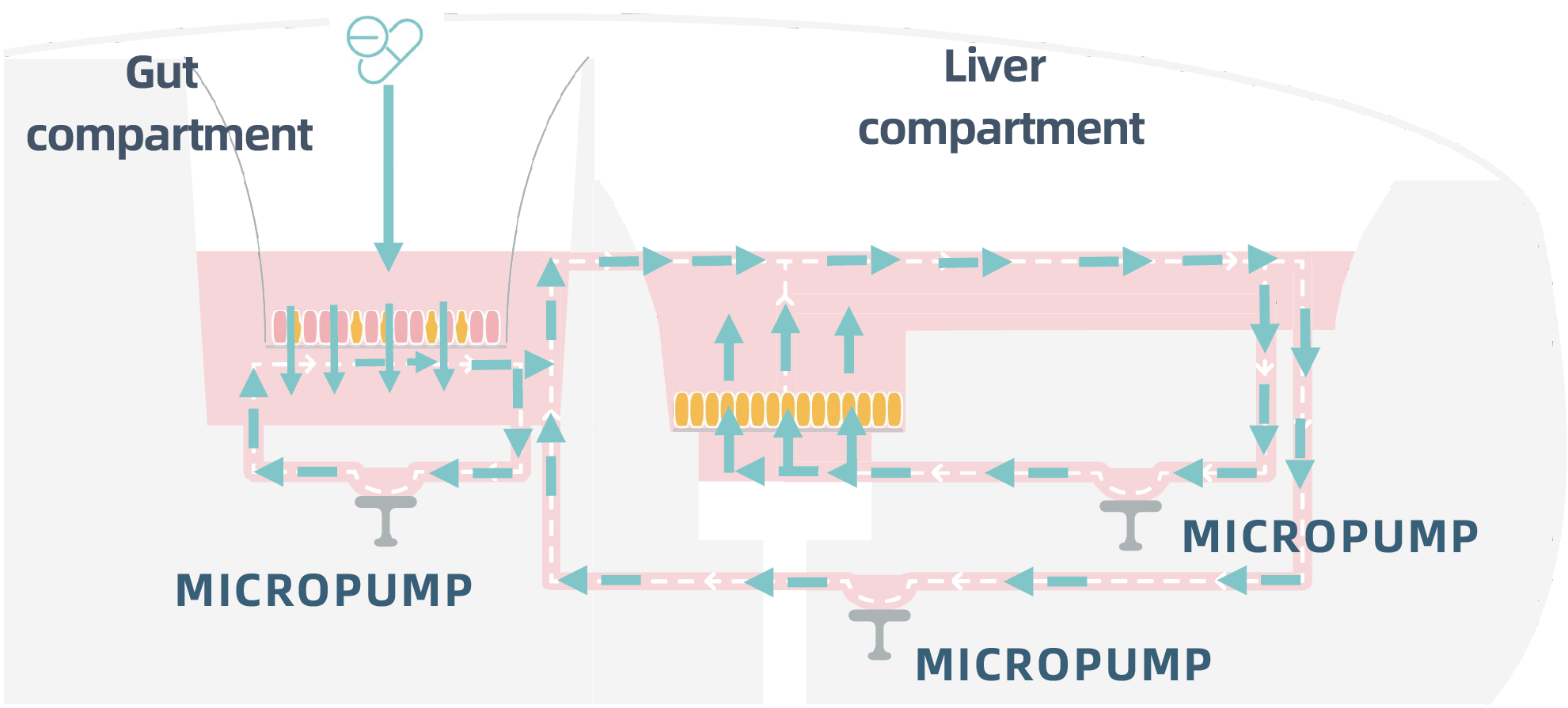
图2
PHH播种4天后,将RepliGut加入双器官板的肠道区,并与其对应的肝脏区流体连接(图2)。ADME 研究开始,药物(Temocapril= 100 μM,Midazolam= 50 μM)在肠道顶端区室中加入。药物通过屏障运输后,混入肠道基底外侧区和肝脏腔室。
结果
01- RepliGut 表现出不同的增殖细胞群和分化细胞群,其顶端表面有一层连续的粘液层(图3)
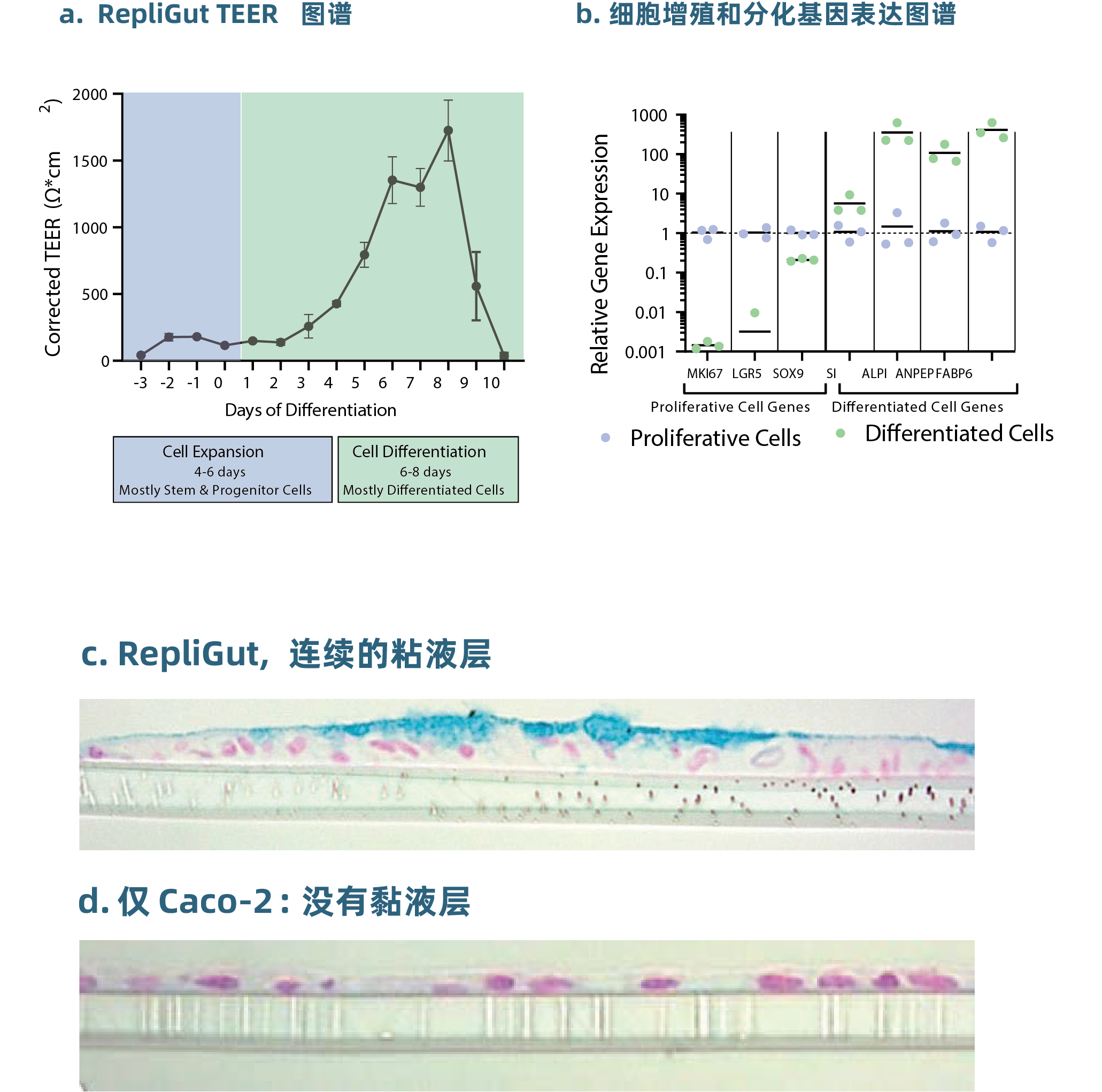
图3
02- 原代肠道细胞与 caco-2 细胞系相比,代谢和转运体基因表达得到改善(图4)
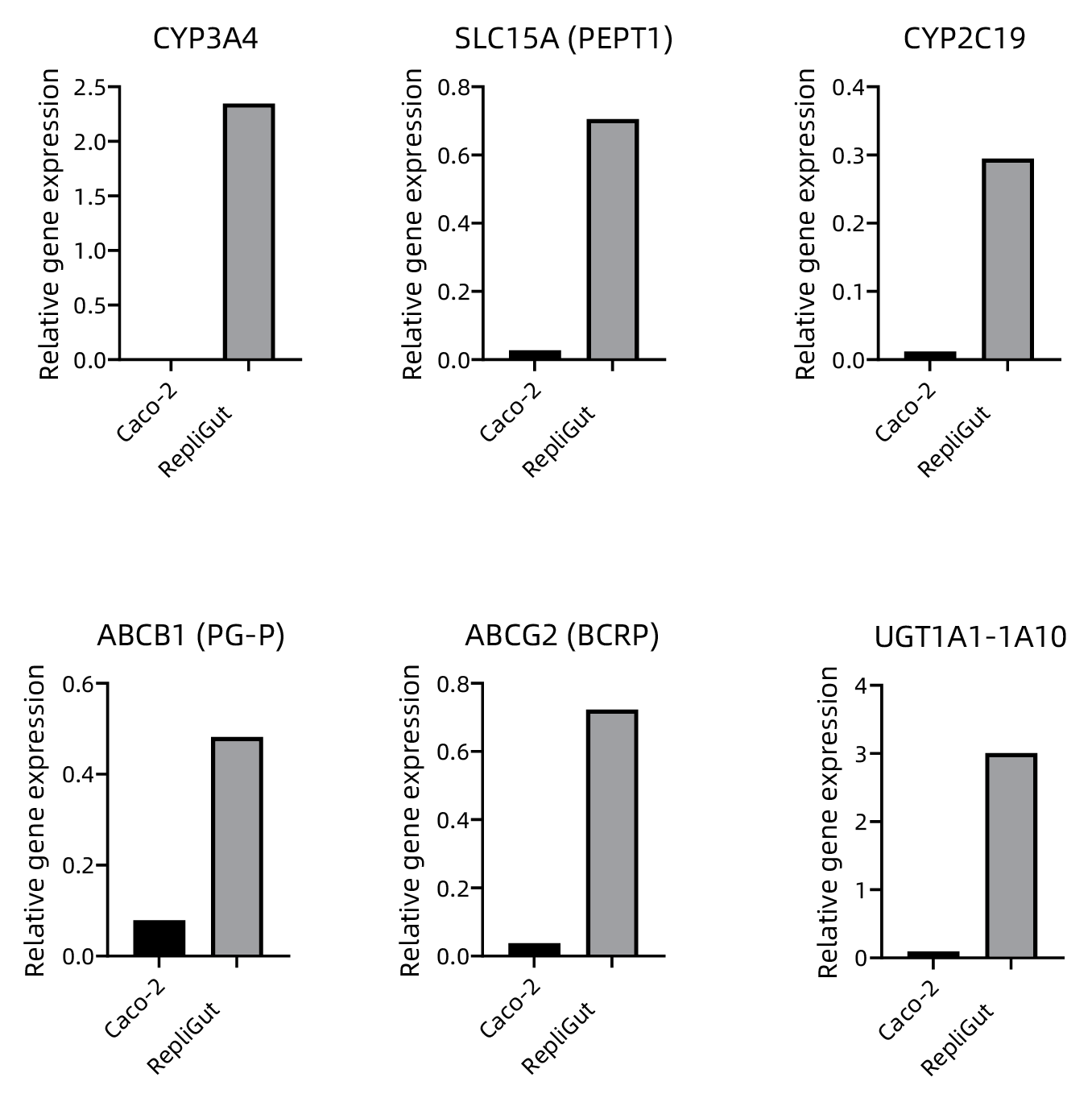
图4
03- 3D肝组织在只培养肝脏和肠道-肝脏共培养中都具有功能性和代谢活性。(图5)

图5
04- 3D肝组织在只培养肝脏和肠道-肝脏共培养中都具有功能性和代谢活性。(图5)
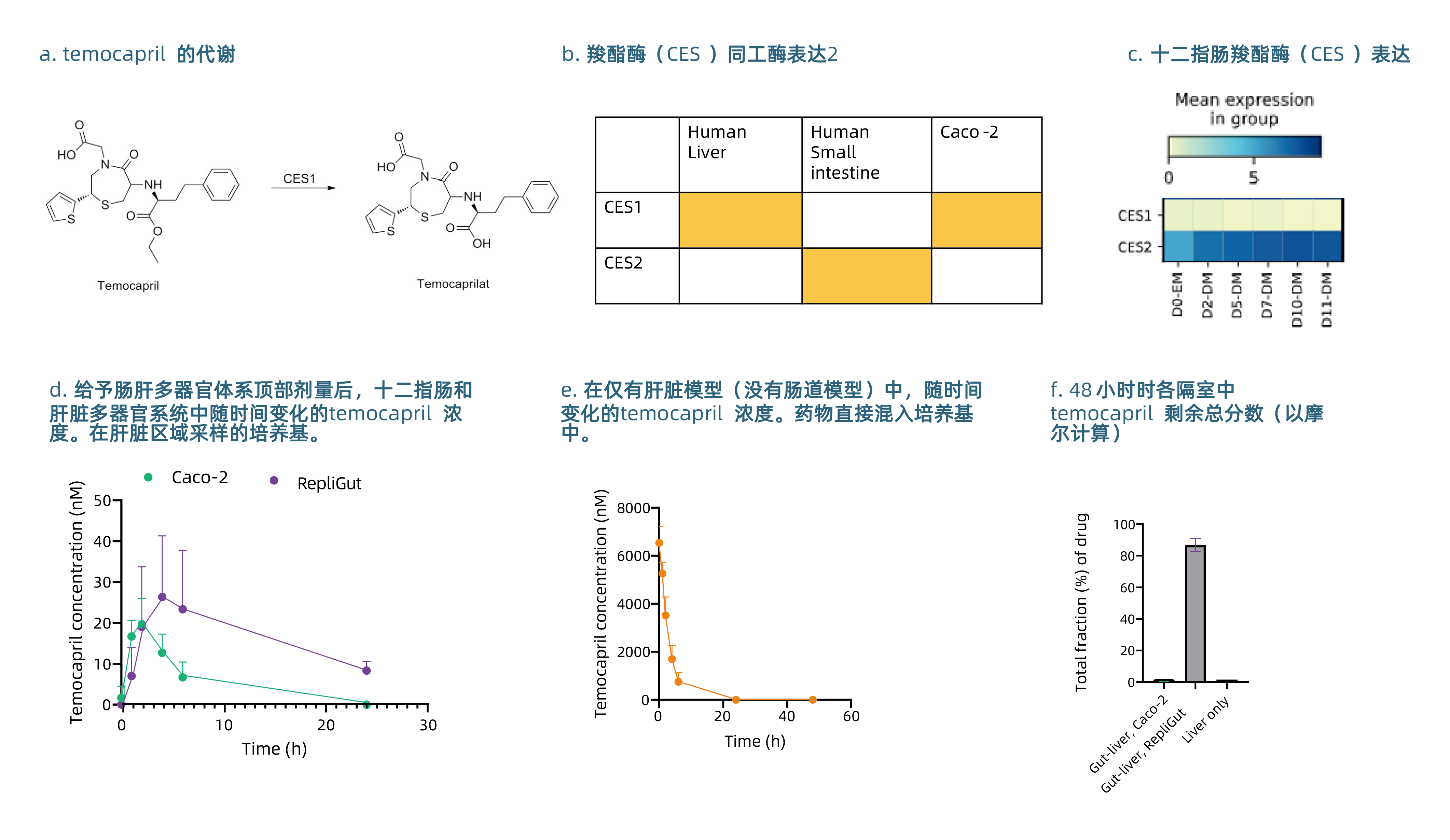
图6
05- 利用原代细胞改进Midazolam在肠道-肝脏 MPS 中的生物利用度预测(图7)。
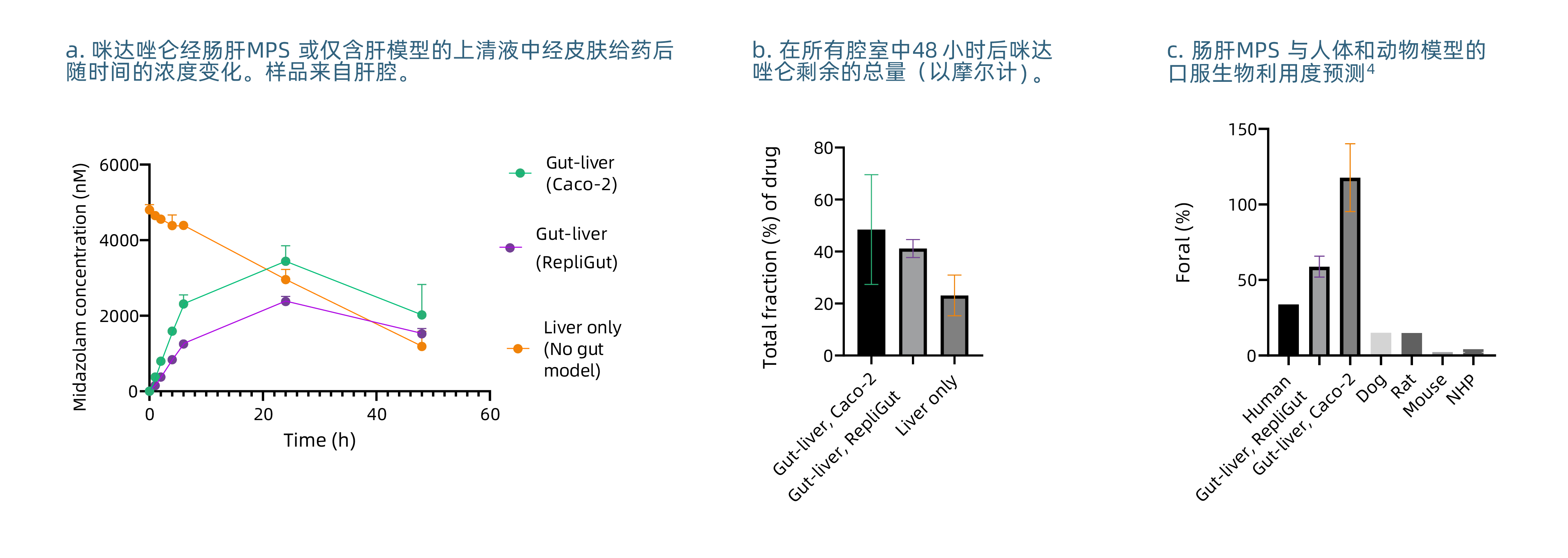
图7
结论
肠肝微生理系统(Gut-Liver MPS)模拟了人体口服用药的生理条件(见图3-5)。这个模型完全由原代人类细胞构成,相比标准体外模型,它能够更准确地进行药物代谢、吸收、分布和排泄(ADME)以及生物利用度研究(见图7)。
这个与人体相关的肠肝模型在研究通过胃肠道酶(CES)代谢的前药(如Temocapril,见图6)的药代动力学方面提供了巨大的改进方法。
【扩展阅读】
参考文献
1. C. D. Edington et al., Sci. Reports 2018 81. 8, 1–18 (2018).
2. T. Imai, M. Imoto, H. Sakamoto, M. Hashimoto, Drug Metab. Dispos. 33, 1185–1190 (2005).
3. C. R. Jones et al., AAPS J. 18, 589–604 (2016).
4. H. Musther, A. Olivares-Morales, O. J. D. Hatley,B. Liu, A. R. Hodjegan, Eur. J. Pharm.Sci. 57, 280 (2014).