发布时间:2024/02/21 点击数:
发布时间:2024/02/21 点击数:本文主要介绍使用肝脏微生理系统评估药物毒性、代谢和积累的可重复性特征。
导读
来自美国药监局(FDA)药物评估和研究中心的研究团队,使用CN Bio的PhysioMimix 微流控器官芯片系统(MPS&OOC)构建肝模型,评估肝MPS在药物毒性、代谢和细胞内积累方面的可行性、准确性、一致性、重现性,并与传统的球体、三明治培养平台做对比,发现不同培养平台在肝的关键指标上存在较为明显的差异,结果证明肝MPS模型更具人体相关性,更适用于代谢、毒性、积累的定量研究,并提出了一些建议与考虑。

研究背景及亮点
1、这项技术是什么?
微生理系统(MPS)被设计用于重现器官或组织特定的细胞外微环境特征,增强培养中细胞的生理相关性。肝MPS通过以3D方式培养细胞并将其暴露于连续液流中,实现了对肝细胞的长期和稳定培养。
2、这项研究解决了什么问题?
相对于其他细胞培养平台,以及肝MPS在评估药物开发和评估问题(如毒性、代谢和药代动力学)方面的可重复性,其功能性表现如何?
3、这项研究对我们的知识有何补充?
肝MPS系统地检测到了曲伐沙星(trovafloxacin)的毒性。与球体和三明治培养相比,该系统具有更稳定的功能,并对曲格列酮(troglitazone)、他莫西芬(tamoxifen)和地高辛(digoxin)具有不同的敏感性。对曲格列酮的二相代谢和氯喹的胞内积累进行定量分析显示了肝MPS用于研究药物代谢和药代动力学的潜在用途。对评估芯片功能的质量控制标准对可靠使用肝MPS至关重要。
4、这将如何改变临床药理学或转化科学?
由于其功能强大和生理相关性(3D培养、细胞暴露于连续液流以及不同细胞类型的共培养),肝MPS可以以可重复的方式:
(i)检测由炎症引起的药物毒性,正如曲非奎新所证明的
(ii)检测其他药物的毒性,如曲格列酮、他莫西芬和地高辛,具有不同于球体和三明治培养中检测到的效果
(iii)进行依赖于细胞活动的延长的肝功能研究,以及(iv)检测二相代谢产物和药物积累,从而可能支持对临床数据的解释。在药物开发中整合MPS将通过对性能和可重复性的仔细评估得到促进,正如本研究所进行的评估。
总体目标
测试肝MPS在可重复预测药物肝毒性、分析药物代谢和胞内药物积累方面的性能。
1、首先通过使用曲伐沙星证明了肝MPS在检测肝毒性物质方面的可重复性。
2、将其与其他肝培养格式进行比较,以了解它们对其他有毒物质和功能性的响应。
3、使用曲格列酮、双氯芬酸和氯喹评估了肝MPS用于药物代谢、清除和分布研究的能力。
4、评估质量控制标准的适当使用,以确保从MPS研究中生成可重复的数据。
研究结果
1、MPS在不同实验场地和不同批次kupffer细胞的结果一致性
测试在两个地点使用肝脏MPS或使用两批不同的PHKCs(每批的批号在补充材料中)是否会导致相同实验之间的结果差异,并将PHHs与PHKCs共培养,暴露于trovafloxaci(T,特异性肝毒性)和levofloxacin(L,肝毒性风险较低)。图1a-c表明,两个实验地点都能观察到,100µM trovafloxacin和LPS处理的样本观察到LDH水平超过基线的4倍,而当LPS没有与trovafloxacin共用时,未检测到LDH产生与对照相比的显. 著差异,无论有无levofloxacin,LPS都将CYP3A4活性降低到基线以下的50%。然而,100µM的trovafloxacin,无论是否有LPS,都进一步将CYP3A4活性降低到基线以下的10%,这些结果与PHKCs的批次无关。
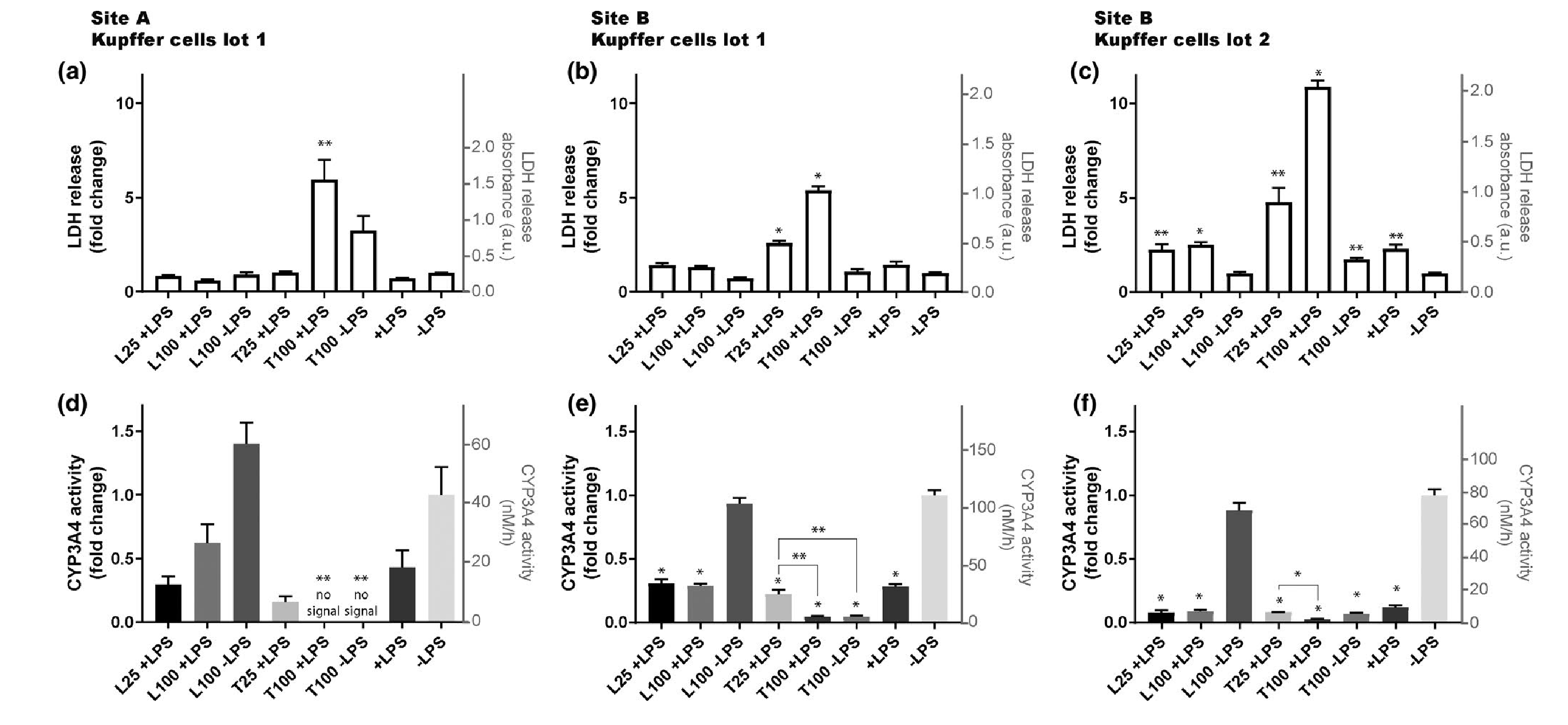
图1:使用在肝MPS中与PHKCs共培养的PHHs在两个不同的实验场地和两个经过验证的PHKCs批次中检测到的曲伐沙星的毒性效应。A.实验场地位于英国剑桥的CN Bio Innovations,B.实验场地位于美国马里兰州银泉的FDA实验室。在肝MPS的细胞培养基中添加曲伐沙星(T)和左氧氟沙星(L)浓度为25或100 µM,在存在(+)或不存在(−)1 µg/ml脂多糖(LPS)的情况下激活PHKCs。暴露2天后,通过测量LDH(a–c)和CYP3A4活性(d–f)在细胞培养基中估计细胞死亡。方框表示平均值,误差条表示SEM。在A实验场地(a,d)和B实验场地(b,e)之间使用相同批次的PHHs和PHKCs。B实验场地还使用了另一批PHKCs(c,f)。对于每组结果,*p < 0.005和**p < 0.05,采用不配对t检验和Welch校正。*和**在柱子上方表示相对于控制 -LPS的差异的统计显. 著性。除非另有说明,否则所呈现条件的值之间的差异与控制 -LPS的值之间在统计上不同。对于(e)和(f),还呈现了T25 +LPS条件和其他条件之间差异的统计显. 著性,例如T100 +LPS(e,f)和T100 -LPS(e)。每个条件使用三个不同的孔,除了在A实验场地进行的实验中,条件L100 +LPS和T100 +LPS使用了4个孔。LDH,乳酸脱氢酶;MPS,微生理系统;PHHs,原代人类肝细胞;PHKCs,原代人类库普弗细胞。
2、在肝脏MPS中培养的PHHs表现出对肝毒素的不同敏感性
为了确定在肝脏MPS中维持的PHHs相对于球状体或三明治培养中的细胞是否对肝毒素的敏感性发生了改变,所有三个平台都暴露于troglitazone、tamoxifen和digoxin的不同浓度(图S2)。这些肝毒素对LDH产生、CYP3A4活性和白蛋白产生的浓度依赖性效应在图2中为每个平台显示。总的来说,结果显示PHHs对这些肝毒素的敏感性取决于使用的细胞培养平台。使用肝脏MPS培养的细胞表现出对troglitazone(MPS,EC50 = 210.9 ± 107.8 μM;球状体,EC50 = 67.1 ± 13.6 μM;三明治培养,EC50 = 35.1 ± 22.2 μM)和tamoxifen(MPS,EC50 = 36.7 ± 3.0 μM;球状体,EC50 = 13.7 ± 2.4 μM;三明治培养,EC50 = 23.8 ± 14.8 μM)的更高抵抗力。相反,肝脏MPS中维持的细胞表现出对digoxin的抵抗程度与三明治培养中的细胞相似(MPS,EC50 = 84.4 ± 30.8 μM;三明治培养,EC50 = 122.3 ± 17.3 μM),而球状体中培养的细胞对digoxin更敏感(球状体,EC50 = 6.4 ± 0.9 μM)。
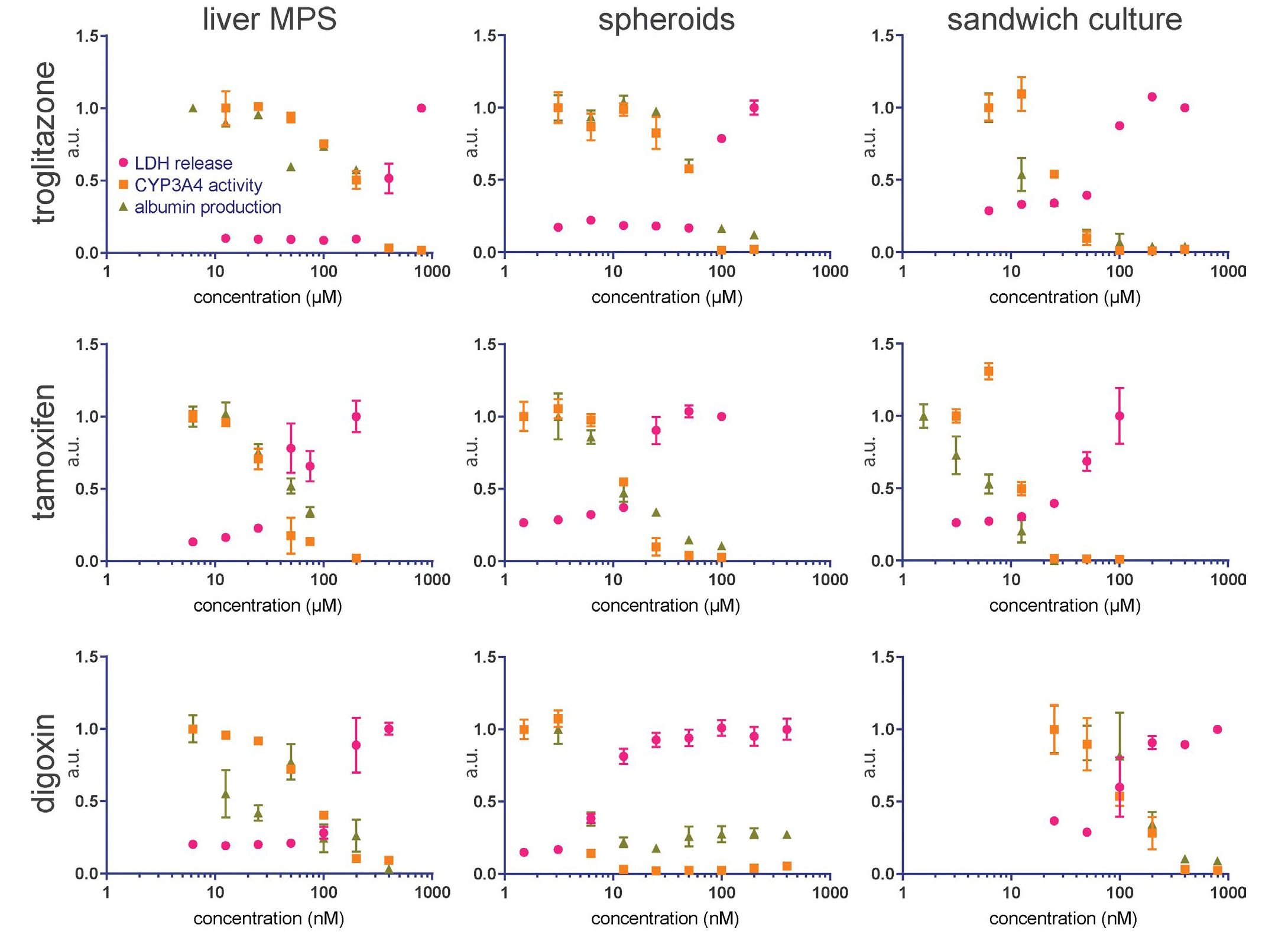
图2:展示了LDH释放(粉红色圆圈)、CYP34A活性(橙色方块)和白蛋白产生(绿色三角形)对48小时内暴露于troglitazone、tamoxifen和digoxin的一系列浓度的反应,这在所有3个平台上都有:肝脏MPS、球状体和三明治培养。所有浓度范围大约覆盖了三个数量级,上下浓度限制被选定为包含每个平台-药物条件下所有三种反应的半最. 大抑制浓度。反应被归一化为最. 低药物浓度(对于LDH来说是最. 高)的记录值,并以任意单位的小数值呈现。每个数据点代表三个生物重复的平均值,误差线表示SEM,如果比符号的大小短则不呈现。一个MPS孔的三个技术重复的结果对800 µM的troglitazone进行了呈现。一个MPS孔的白蛋白测量的三个技术重复的结果对6.25 nM的digoxin进行了呈现。LDH,乳酸脱氢酶;MPS,微生理系统。
在肝脏MPS和球状体培养中,CYP3A4活性和白蛋白产生的减少发生在LDH产生增加的肝毒素浓度以下(表1)。这些结果表明,肝功能的丧失可以在细胞死亡之前发生。LDH、CYP3A4和白蛋白终点获得的剂量-毒性曲线在肝脏MPS和其他两个平台之间通常具有良好的相关性。在所有测试的毒素中,troglitazone的效应在平台之间以及在同一平台的终点之间变化最. 大。这些结果表明,每个平台/独特的微环境可能会不同地影响肝功能和毒性。
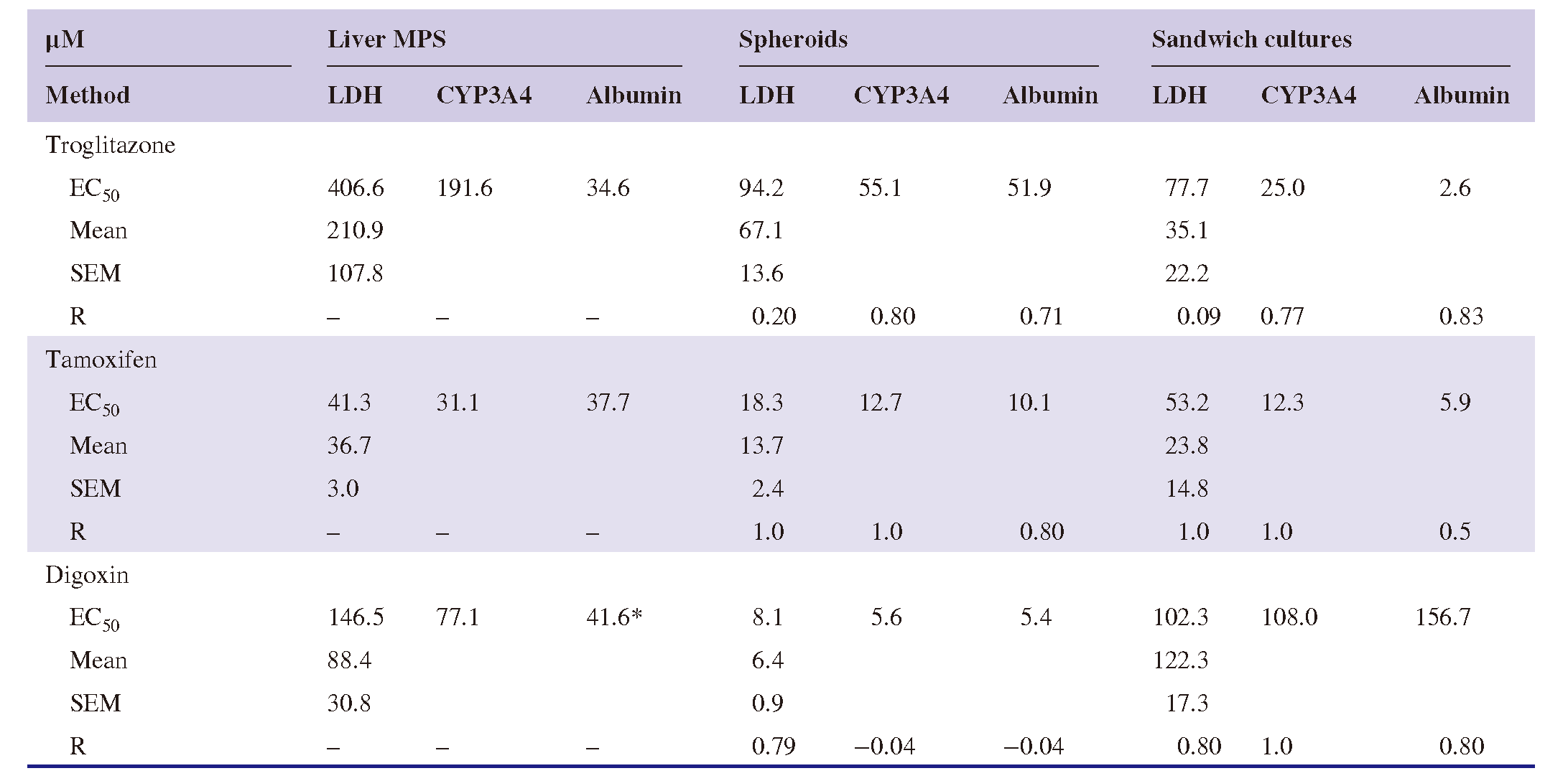
表1:估计的浓度值,这些值产生LDH的量、CYP3A4活性和白蛋白分泌的EC50变化,当在不同平台(肝脏MPS、球状体和三明治培养)中培养的肝细胞暴露于troglitazone、tamoxifen和digoxin的不同浓度时。EC50值的SEM是从每个功能终点对肝毒素的不同浓度的变化计算的。*-最. 大值设为1以计算此值。呈现的相关参数r是从非参数Spearman相关测试计算的,相对于肝脏MPS中的相应类型的反应,为每种类型的反应(LDH,CYP3A4和白蛋白)计算的。缩写:EC50,半最. 大有效浓度;LDH,乳酸脱氢酶;MPS,微生理系统。
3、相较于其他培养平台,肝脏MPS中的PHH细胞功能更稳定
为了确定肝脏MPS PHHs对肝毒素的敏感性改变是否可能是由于它们的功能稳定性随时间的改变,我们在没有肝毒素的情况下连续监测了每个培养平台的CYP3A4活性和白蛋白产生。如预期,所有测试的平台的CYP3A4活性(图3a,b)在初始测量后随时间减少。然而,变化的倍数在平台之间是不同的,当归一化到从细胞裂解物中定量的蛋白质含量(图3a)或种植细胞的总数(图3b)时,球状体中的CYP3A4活性与其他平台发散。相对于三明治培养,球状体中的CYP3A4活性较高,并且在归一化到种植细胞的数量(图3b)时,在MPS活性的范围内,而不是裂解蛋白的量(图3a)。尽管在相对球状体活性的归一化策略之间存在分歧,但肝脏MPS中的CYP3A4活性比其他平台降低的速率较慢。
为了进一步评估PHH培养的功能稳定性,从每种类型的细胞培养平台测量了白蛋白产生,直到培养的第19天,并归一化到实验后裂解的细胞蛋白的量(图3c)或种植细胞的数量(图3d)。在白蛋白产生中,当归一化到种植细胞的数量时,球状体和三明治培养在第3天相对于MPS呈现出更高的值。独立于归一化策略,球状体和三明治培养中的白蛋白值随着培养时间的推移而减少,而在MPS中则增加。三明治培养中的白蛋白在10天内降低到最. 低水平,在球状体中的12天内降低到第3天水平的50%以下。相比之下,白蛋白产生在第3天后的MPS中随着时间的推移增加到1倍以上,在第15天左右达到峰值。
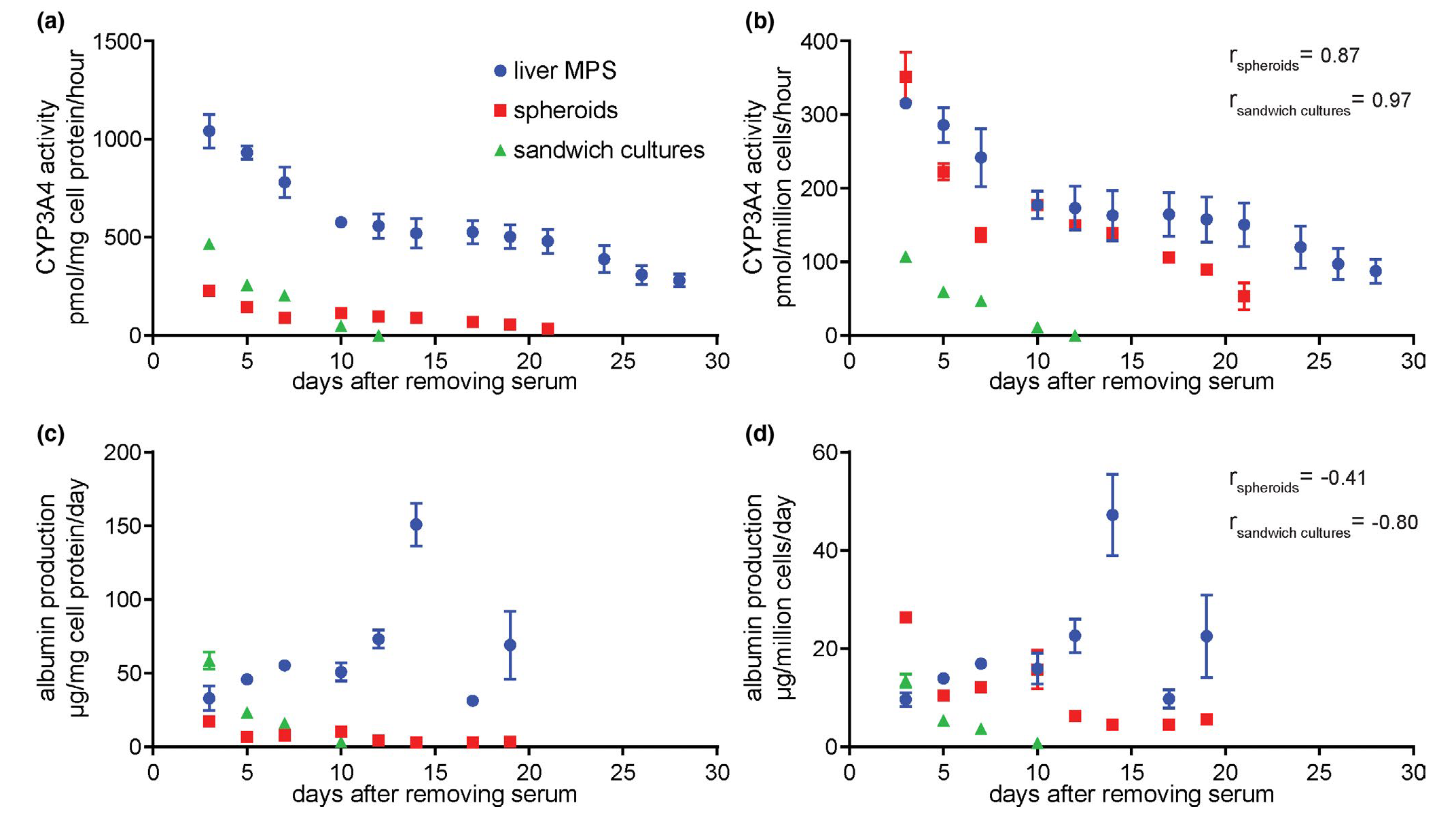
图3:当细胞在肝脏MPS中培养时,肝功能持续的时间更长,且更稳定,而不是作为球状体或三明治培养。PHHs在肝脏MPS、球状体和三明治培养中培养,这些平台的功能被分析。(a, b) 在离散的时间点为每个培养平台测量了平均CYP3A4活性,并且 (a) 归一化到细胞材料的总蛋白质或 (b) 归一化到每个平台使用的细胞数量。(c, d) 在不同的时间点进行白蛋白产生,并且 (c) 除以从平台裂解的总细胞蛋白质和介质更换之间的天数或 (d) 除以使用的细胞数量和介质更换之间的天数。分析了肝脏MPS的三个孔,三个球状体和六个带有三明治培养的孔。误差线对应于SEM,如果短于符号的大小则不呈现。进行了单因素ANOVA以评估最. 多10天培养的均值之间的方差。对于CYP3A4活性 (b),肝脏MPS的ANOVA p值为0.022,球状体的p值为< 0.0001,三明治培养的p值为< 0.0001。对于白蛋白产生 (d),肝脏MPS的p值为0.1,球状体的p值为0.002,三明治培养的p值为< 0.0001。相对于肝脏MPS中的功能变化,从非参数Spearman相关测试计算的相关参数r在 (b) 和 (d) 中为球状体(rspheroids)和三明治培养(rsandwich cultures)的功能变化呈现。ANOVA,方差分析;MPS,微生理系统;PHHs,原代人肝细胞。
4、II相药物代谢产物的量化和药物细胞内积累
表征人类特异性药物代谢和细胞内积累是肝脏MPS在药理学中最. 相关的应用之一。考虑到troglitazone可以产生第二阶段的代谢物,我们使用这种化合物来探索肝脏MPS在检测和定量第二阶段代谢物以及第一阶段代谢的实用性。将troglitazone应用到肝脏MPS后,对于测试的两种浓度,troglitazone在48小时的孵化后几乎完全被代谢(图4a)。如预期的对生理相关代谢的建模,troglitazone的第二阶段代谢物(葡萄糖醛酸化和硫酸化)在细胞培养基中被定量,其中在50µM的troglitazone中检测到的量比在100µM的troglitazone中更高,可能是由于在最. 高浓度时对代谢途径的毒性效应。接下来,通过分析来自肝脏MPS的培养基样本,对diclofenac的代谢进行了定量,并且其浓度观察到随时间减少,显示出它被代谢。然而,经葡萄糖醛酸化的diclofenac在37°C的溶液中在孵化2小时内变得不稳定,因此在48小时后没有在MPS培养基中检测到,就像在troglitazone中检测到的那样。因此,如果在细胞培养基中稳定,可以检测到在肝脏MPS中的PHHs产生的第二阶段代谢物(支持材料)。
为了评估肝脏MPS在定量相对于细胞外环境的细胞内化合物积累的潜力,我们将在MPS中培养的PHHs暴露于氯喹chloroquine(图4b,c),因为已知它在体内积累在肝脏中。处理后,chloroquine在细胞裂解物中被检测到,其量是细胞外培养基的五倍。为了确保这些结果不受化合物吸附到MPS材料的影响,lidocaine、phenacetin、propranolol、prednisolone、diclofenac和ibuprofen的浓度在肝脏MPS中48小时循环前后的培养基中测量。如支持材料图S12所示,当在肝脏MPS中循环前后测量时,这些化合物的浓度没有观察到显. 著的变化。这些数据表明,在模拟细胞内药物积累时,化合物和微流体材料之间的非特异性相互作用的参与最. 小。然而,具有不同物理化学性质的其他化合物可能会结合到设备上,因此可能需要在测试前进行类似的评估。
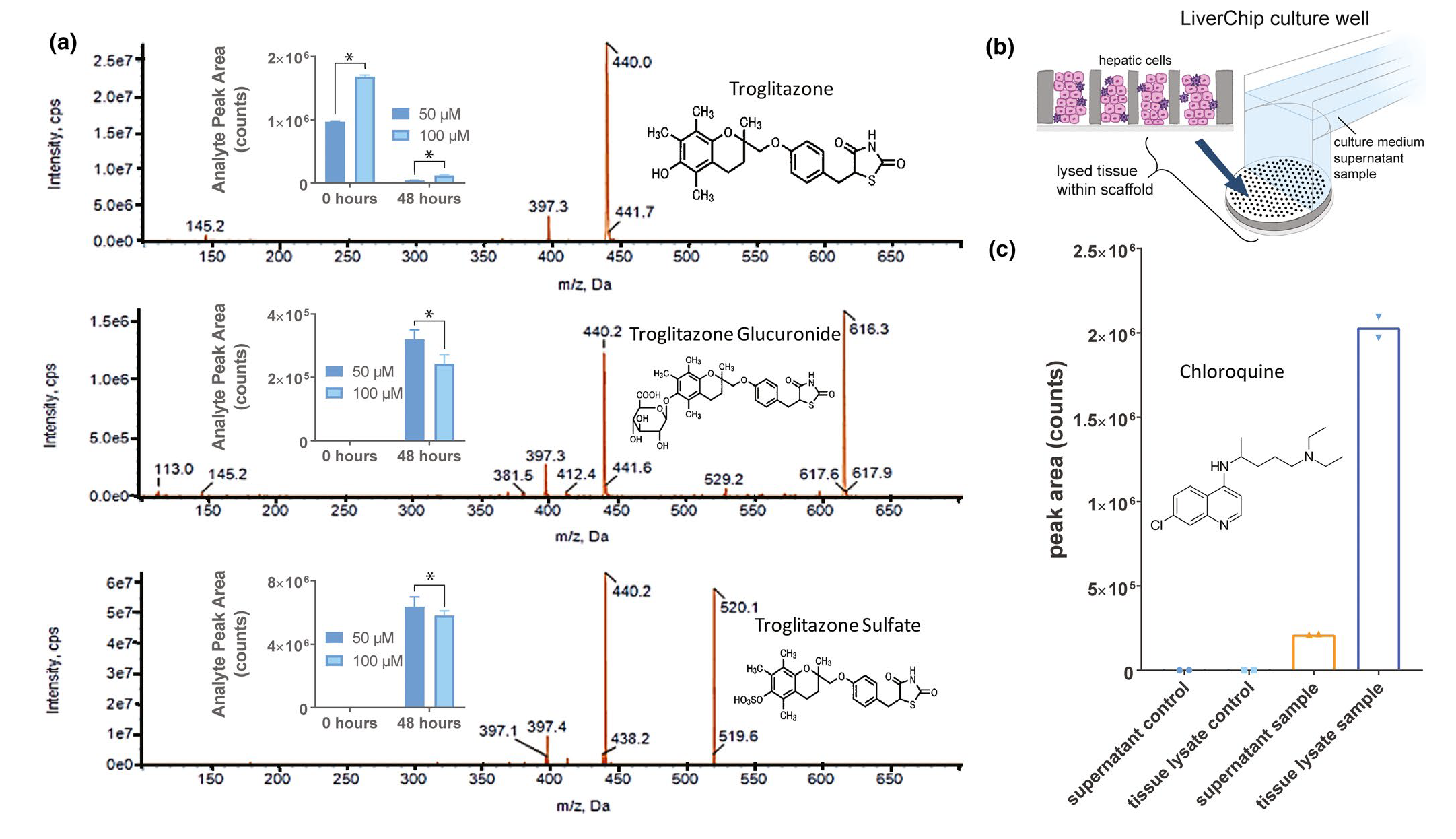
图4:肝脏MPS在药物代谢和药代动力学研究中的应用。(a) 检测troglitazone的第二阶段代谢物:troglitazone葡萄糖醛酸酯和troglitazone硫酸酯。含有50或100µM troglitazone的培养基被加入到每个浓度的肝脏MPS的3个孔中,并维持2天以进行代谢。在加入肝脏MPS之前和之后,通过液相色谱-质谱法检测了培养基中的troglitazone和代谢物。*p < 0.03,通过非配对的Mann-Whitney非参数测试。误差线对应于SD。(b) 除了分析肝脏MPS中的上清培养基外,还将支架内的细胞裂解以评估药物的组织内积累。(c) 含有31.5µM chloroquine的培养基被加入到肝脏MPS的2个孔中,并孵化2天,以在消化含有细胞的支架后通过液相色谱-质谱法测量其组织内积累。对于两个样本,相对于上清样本,在组织裂解物中观察到chloroquine的浓度高出10倍。MPS,微生理系统。
5、通过测量CYP3A4活性和LDH产生对单个MPS孔进行质量控制
为了验证使用非破坏性和微创检测作为MPS复制的可靠质量控制指标,我们测量了灌流物中的CYP3A4活性和LDH产生(图5a,b),并结合支架成像(实验后)和基因表达分析(成像后:图5c)。这些参数在单个肝脏MPS板中的单个孔进行了研究(图5),其中成像和基因表达分析被用作质量控制参数的确认测量。对一个肝脏MPS板(12个孔)的分析显示,特定孔(B6)的LDH产生显. 著大于其他孔(图5a)。根据这个结果,B6孔的支架图像显示出比其他孔低的细胞计数(图5c),从而确认了基于这个标准的不适用性。尽管在测定CYP3A4活性(图5b)时观察到了较高程度的孔间变异性,但这个测量似乎与异常的细胞密度相吻合,如支架A3所示,它表现出低的细胞密度以及非均匀的细胞分布。然而,在某些情况下,CYP3A4活性和微组织的视觉特征之间的关系并不明显,如支架A6和B5所示,它们在视觉上类似于支架B4(图5c)。对于每个用于实验的板,我们取消了与高LDH产生值相关的孔收集的数据,这些值是统计离群值或CYP3A4活性低于最. 大测量值的50%。孔A3和B6显然符合这些排除标准,如果孔A6和B5被识别为统计离群值,将被标记以供以后考虑。
为了进一步测试这些标准是否能有效地区分功能孔和缺陷孔,我们分析了使用特定途径的聚合酶链反应阵列筛选的84个基因在孔间的变异性,该阵列用于检测人类药物代谢。B6孔的总RNA产量低于建议的400 ng输入水平,因此被排除在分析之外。根据药物代谢面板中的84个基因的表达,对测试的样本进行了层次聚类(图5d)。对基因表达分析数据进行了主成分分析,以更好地评估孔聚类(图5e)。总的来说,孔之间的基因表达没有观察到主要差异,然而,孔A3和B2与其他孔分开聚类。孔B2与其他孔聚类更接近,而不是A3。基于样本的无偏聚类分析(图5d,图S13),在由孔A1、A2、A4、A5、B1、B3、B4和B5组成的对照组中,孔A3、A6和B2被分类为离群值。相对于对照组,离群组的基因表达的倍数变化在图S14中呈现,而在组之间变化显. 著的基因列在表S2中。在测试的84个基因中,有8个在离群组中上调,11个相对于对照组下调。总的来说,这些结果支持使用LDH产生和CYP3A4活性作为进行肝脏MPS实验的可靠、非侵入性的质量控制指标。此外,从灌流物中定量的其他肝生物标志物或代谢测定也可能是同样有用的质量控制指标,这可能取决于使用的上下文。
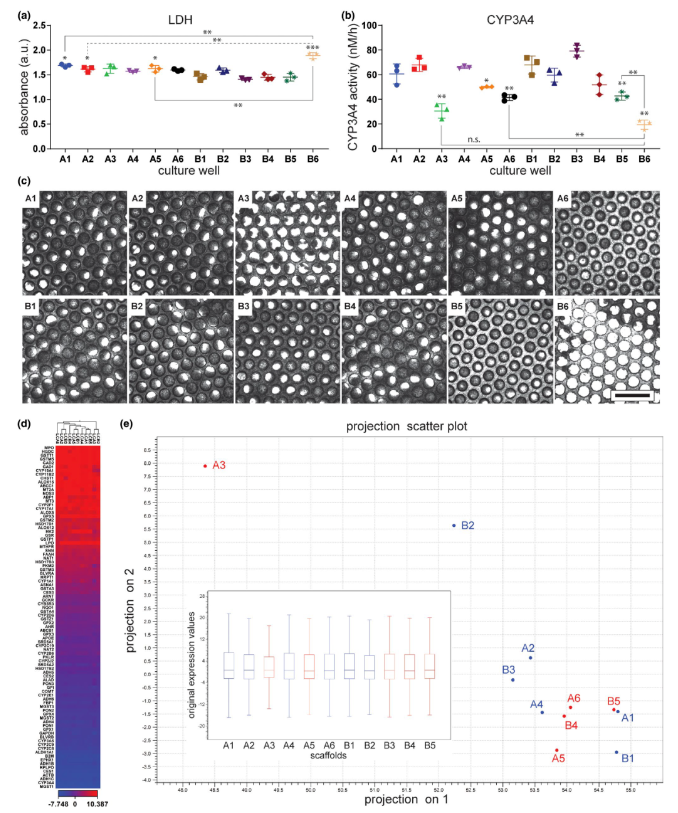
图5:评估LDH产生和CYP3A4活性作为单个孔的质量控制措施。在播种细胞后的运行第4天更换细胞培养基之前,从每个孔收集的培养基中测定了LDH(a),并测量了CYP3A4活性(b),以评估肝脏MPS板孔的细胞功能的质量。误差线代表三个测量的技术重复的SD。*0.05 < p < 0.02 和 **0.02 < p < 0.002 和 ***p < 0.002 由未配对的t检验与Welch's校正。在呈现的数据集上方的*,**和***表示相对于B1孔的值的均值的LDH或CYP3A4产生的差异的统计学显. 著性。除非另有指示,否则呈现的均值与从B1孔获得的均值在统计学上没有差异。(c) 每个对应于肝脏MPS孔的支架在从板中移除后用明场显微镜成像。刻度条代表1毫米的长度。对于基因表达分析(d,e),使用Qiagen的RT2 Profiler PCR Array进行人类药物代谢评估,涉及84个参与药物代谢的基因。由于样本B6的产量低于测定所需的产量,因此从基因表达分析中排除。面板阵列上五个最. 小变异目标的均值被用作归一化Ct值(ΔCt)计算的分母的内源性控制值。(d) 基因表达的层次聚类图。热图代表一组基因(行)的表达的ΔCt,用于每个隔离的支架(列)。欧几里得距离和平均链接被用作聚类的参数。(e) 来自软件CLC Genomics Workbench(Qiagen)的主成分图,描绘了样本在由协方差矩阵的第一和第二主成分跨越的二维空间上的投影。主图内的箱线图呈现了ΔCt值的分布。LDH,乳酸脱氢酶;MPS,微生理系统;n.s.表示不显. 著。
结论
肝脏MPS的可重复性是根据其预测肝毒性、估计药物代谢和积累以及研究需要细胞长期功能的药物效应的潜力进行表征的。基于细胞的药物开发方法必须健壮、产生可重复的结果、具有明确定义的质量控制标准、并依赖于可以轻松获取或制造的材料。在当前的研究中,我们遵循了这一指南,使用了商业上可获得的细胞、设备、仪器和供应品。
运用MPS面临的一个挑战是将MPS从学术团体转移到药物开发实验室,这些团体通常具有在微细加工和仪器方法方面的独特专业知识,或者对细胞类型的半du jia访问权。除了来自行业的努力,我们还创建了测试中心来解决这些转化障碍,初步结果显示了不同药物开发利益相关者生成关于MPS使用的关键表征数据的需求。我们的数据证明,尽管肝脏MPS能够分析药物代谢,但应该仔细注意代谢物的稳定性和样本收集的时间。
我们在MPS中培养的PHHs内检测到的chloroquine与体内结果一致,并证明了MPS用于药物分布研究的潜力。细胞运输在调节积累中起着核心作用,MPS研究已经通过药物清除、基因表达和成像测定报告了强大的运输活性。与已发表的结果一致,我们的数据证实了MPS预测药物代谢和药代动力学的潜力,应该用肝脏MPS探索药物开发的其他应用,因为已经开发了多种类型的肝系统,未来的工作应该比较它们以评估每个模型的优点和缺点。
总体而言,这项研究的结果与已发表的数据一致,表明肝脏MPS可以重现结果。使用质量控制标准产生功能性微组织是实现可重复性的关键。此外,肝脏MPS相对于其他PHH培养平台稳定了肝功能。除了这项研究,未来的工作应该评估肝脏MPS作为药物开发工具在特定使用环境中的价值。