发布时间:2022/05/18 点击数:
发布时间:2022/05/18 点击数:3D细胞培养技术的介绍
细胞培养技术是生命科学行业最常使用的实验技术,可以允许实验者在体外模拟体内环境来维持细胞结构和功能,开展早期的药物研发或者基础生命科学研究。传统的细胞培养是在合适的培养器皿中进行单层的细胞培养,故又称为2D细胞培养。然而,科研人员发现这种实验方法在细胞培养的过程中可能发生细胞形态改变、分裂异常、部分分化活性丧失等现象,导致细胞的形态、功能以及应激反应等与其在体内环境下差别巨大,由此构建的细胞模型与体内实际情况相差甚远。
3D细胞培养技术的诞生为科研人员提供了更贴近真实体内环境的细胞模型。3D细胞培养可以弥补单层细胞培养过程中的许多缺陷,例如:
(1)3D细胞模型可以良好地模拟在体的细胞微环境:气体、营养物质、代谢产物等物质呈现具有梯度的浓度变化。
(2)3D细胞模型可以良好地模拟细胞间的相互作用:立体的细胞间接触和直接或间接的细胞间交流。
(3)3D细胞模型可以良好地模拟细胞的生化和生理反应:细胞接受内部或外部刺激时的反应更加符合真实的体内反应。
因为这些优势,3D细胞培养技术在药物研发、干细胞培养、器官再生等研究领域已经展现出了出色的表现。
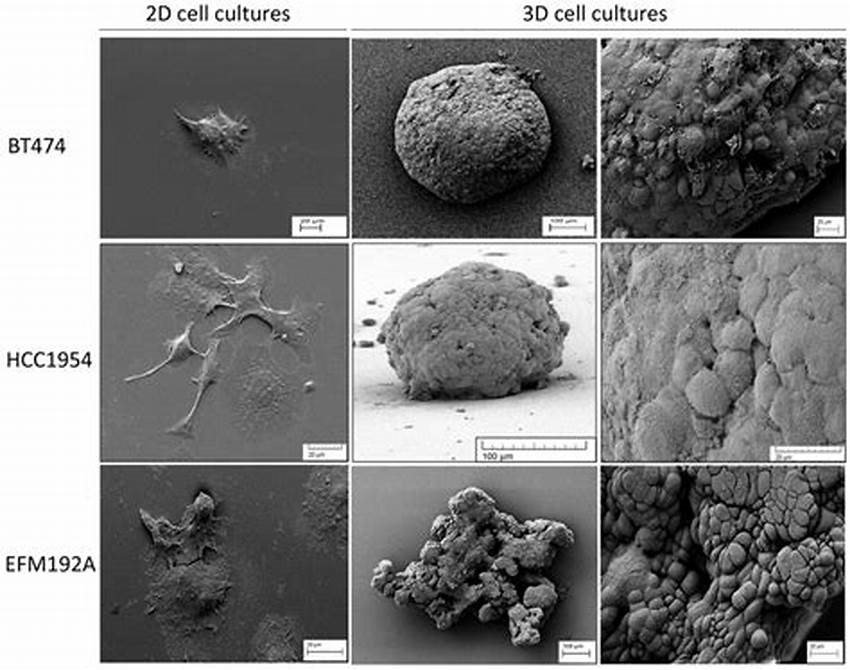
使用不同细胞系进行2D或3D细胞培养时的细胞形态
(Breslin et al., Oncotarget., 2016)
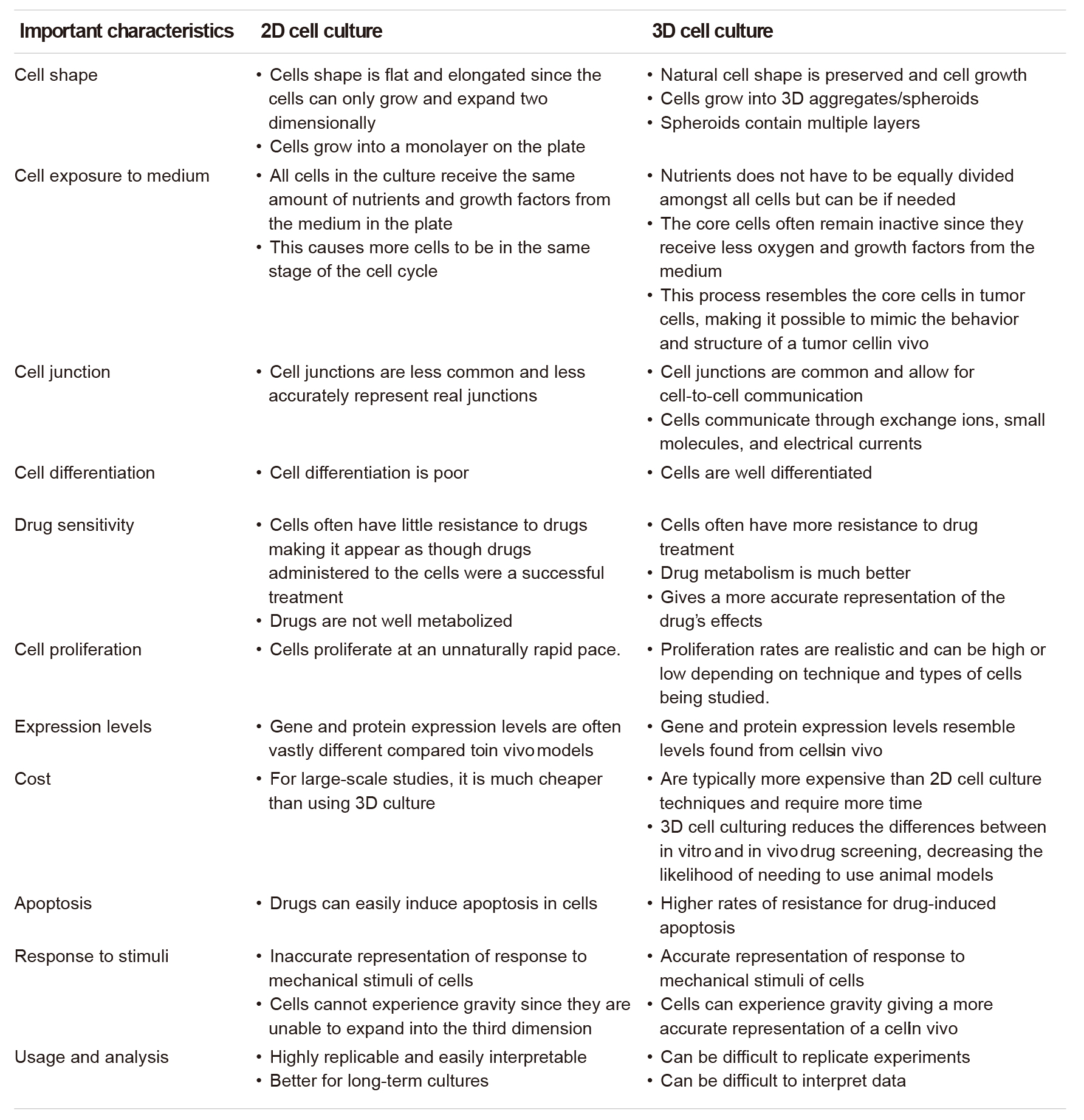
2D和3D细胞模型的特征比较
(Jensen et al., Front Mol Biosci., 2020)
近年来,随着技术的应用和发展,3D细胞培养的相关研究迎来了新的高峰。利用“3D Cell Culture”作为关键词在PubMed网站中进行检索,共返回20282条记录(截至2022年4月),其中53%的文章发表于近五年,83%的文章发表于近10年。3D细胞培养技术正在被越来越多的科研人员接受和采纳,用于改善细胞模型以提高研究可信度。
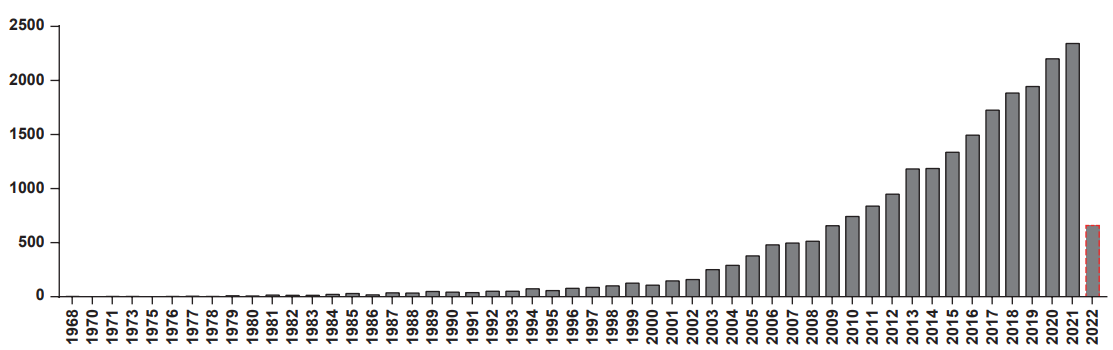
“3D Cell Culture”作为关键词的PubMed搜索结果
(数据来源于PubMed)
3D细胞培养技术的应用
传统的2D细胞模型可以帮助我们理解复杂的细胞生理学、细胞功能和应激反应,而3D细胞模型使我们更接近真实的体内环境,并从多种途径为科研人员提供有用的见解。
1、药物研发与替代性模型
药物研发是一个漫长且高风险的过程,往往意味着巨大的时间、金钱投入和较高的失败率:数据表明,进入临床的药物平均失败率为90%,最终只有10%获批上市。使用2D细胞模型虽有助于揭示许多的生理和病理过程,但无法模拟体内复杂的细胞微环境,造成了体内和体外药理作用或毒理作用的不一致。动物模型价格昂贵,周期长,涉及伦理道德问题,且具有种属差异使得往往在临床前动物模型中获得的良好结果无法在人体临床中得以重复。这表明迫切需要新的方法和技术来提高药物发现的效率。
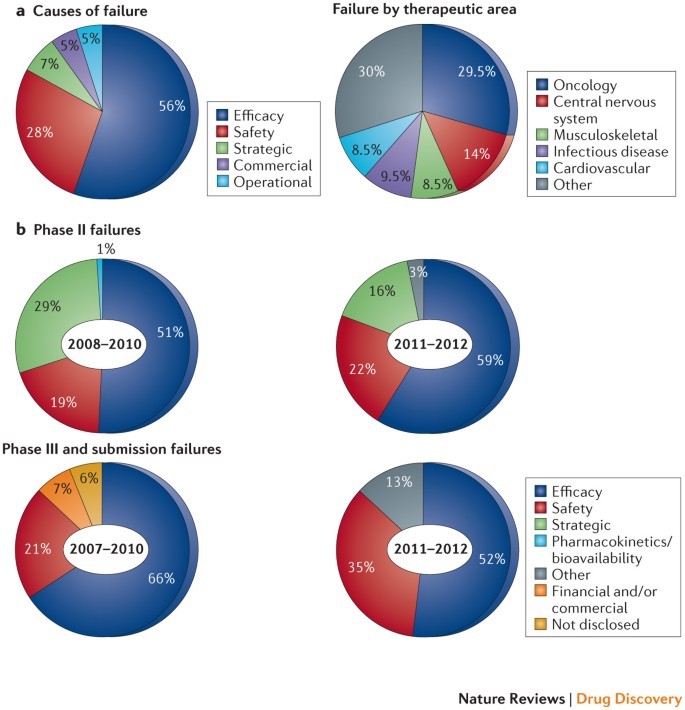
2011-2012年间II期和III期临床试验失败的原因统计
(Arrowsmith et al., Nat Rev Drug Discov., 2013)
近年来,3D细胞模型已经成为药物发现的方法之一,在药效评估的过程中更具洞悉力和预测力,也可以避免使用小鼠等动物模型。此外,在2021年底国家药品监督管理局药品审评中心(CDE)发布的基因治疗和细胞治疗相关的指导原则中,明确指出“当缺少合适的动物模型满足试验需要时,可以使用类器官(3D细胞培养产物,可以重现所代表器官的一些关键细胞类型和结构特征)等替代性模型开展试验”。
2、利用干细胞构建类器官模型
2D细胞培养无法准确复制干细胞的体内微环境,使得其增殖能力和分化活性降低。然而,利用3D细胞培养手段得到的干细胞可以表现出与体内相似的细胞形态、应激反应、基因表达模式,细胞的活性和存活率也得到明显改善。例如使用骨髓来源的间充质干细胞(MSCs)进行3D细胞培养得到的细胞模型具有更高的细胞因子旁分泌能力、更强的抗凋亡和抗氧化能力。

使用人多能干细胞构建的可以“跳动”的心脏类器官
(图片来源于Mendjan实验室)
近年来,随着诱导多能干细胞(iPSCs)的技术发展,利用iPSCs进行3D细胞培养构建人体类器官模型的技术方案也逐渐成熟,由此构建的可以“跳动”的心脏类器官模型、血管类器官模型等不仅可以实现器官的生理功能,还具有与真实器官相似的中空腔体结构并表达相似的标志物。此外,利用干细胞构建的类器官模型在组织工程方面颇具潜力,有望成为组织移植的优良供体。
3、通过微流控系统构建类器官芯片
类器官模型可以很好地模拟真实器官的主要特征,然而无法模拟体内的血液流动或多器官间的相互交流。结合3D细胞培养、微流控、微芯片、微电子等工程技术的交叉应用——类器官芯片应运而生,为科学家们带来了新的研究利器。使用干细胞进行培养并分化成为相应的类器官,通过微流控技术控制芯片内培养基的流动并形成适合的剪切力、压力以及张力等,由此构建的人体类器官芯片在高通量药物筛选、药物吸收代谢、人体循环系统研究、人工仿生微环境、细胞间互作以及细胞与细胞外基质互作、新型体外培养平台等方面都有所发展。

肝脏微流控芯片
(图片来源于CN Bio Innovations)
器官芯片模型不仅可以建立更好的器官模型,还可以进行高分辨率实时成像和代谢分泌产物的长时辰动态监测,从而更容易分析人体组织中存在的体外生化、遗传和代谢活动。
4、肿瘤模型构建与免疫治疗
开发精确的肿瘤模型以了解肿瘤特征是揭示癌症病理过程以及相应治疗方法研发的关键。尽管培养技术简便的2D肿瘤细胞模型仍在被广泛使用,但由于其无法模拟肿瘤细胞的病理生理学,往往无法得到真实可信的实验数据。使用3D细胞培养方法得到的肿瘤细胞模型因具有体外重塑肿瘤微环境的能力而成为肿瘤细胞生物学研究的焦点。肿瘤模型也可以用于基因表达和细胞信号通路的研究,并通过映射比较评估现有的2D细胞模型的准确性和代表性。3D细胞模型可以模拟体内肿瘤细胞的表型变化并拥有更加真实的蛋白活性,这使得在体外的免疫疗法评估实验中,可以展现比2D细胞模型更加真实的免疫杀伤反应。通过构建更具洞悉力的肿瘤模型,3D肿瘤细胞模型已被应用于细胞毒T细胞攻击评估、耐药评估、肿瘤细胞侵袭和转移机制研究等研究领域。
3D细胞培养方法
3D细胞培养技术的难点是保证细胞的三维立体结构并保持自然的增殖和分化活性。随着数十年的持续发展,3D细胞培养的方法也在不断革新,而目前常用的方法主要分为基于支架的3D细胞培养方法和无支架的3D细胞培养方法两种。顾名思义,前者是利用天然或人造的且具有良好生物相容性的微孔物质搭建出具有容纳细胞生长空隙的“脚手架”,细胞依附其作为支撑并向三维空间生长;后者则是利用了细胞自聚集的原理,通过创建适合细胞聚集的生长环境促进细胞形成微球体。
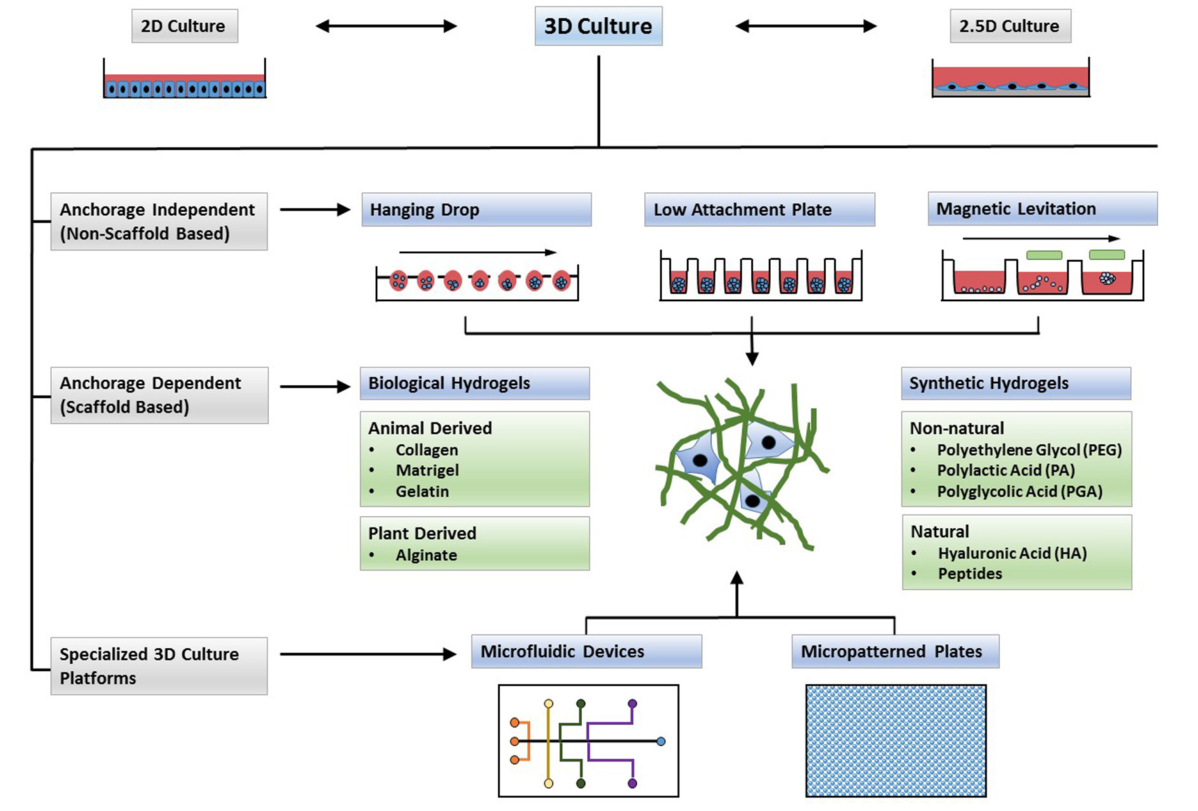
3D细胞培养方法总览
(Langhans, Front Pharmacol., 2018)
1、基于支架的3D细胞培养
基于支架的3D细胞培养方法发展历史悠久,具有大量的文献支持。用于细胞培养支架的材料有琼脂糖、胶原蛋白、纤维连接蛋白、明胶、层粘连蛋白等。这些复合材料通过孔隙率、纤维、渗透性和机械稳定性模拟天然细胞外基质(ECM),能够良好地模拟体内环境中细胞与细胞间的相互作用以及细胞与细胞外基质间的相互作用,同时允许细胞在支架上聚集、增殖和迁移。
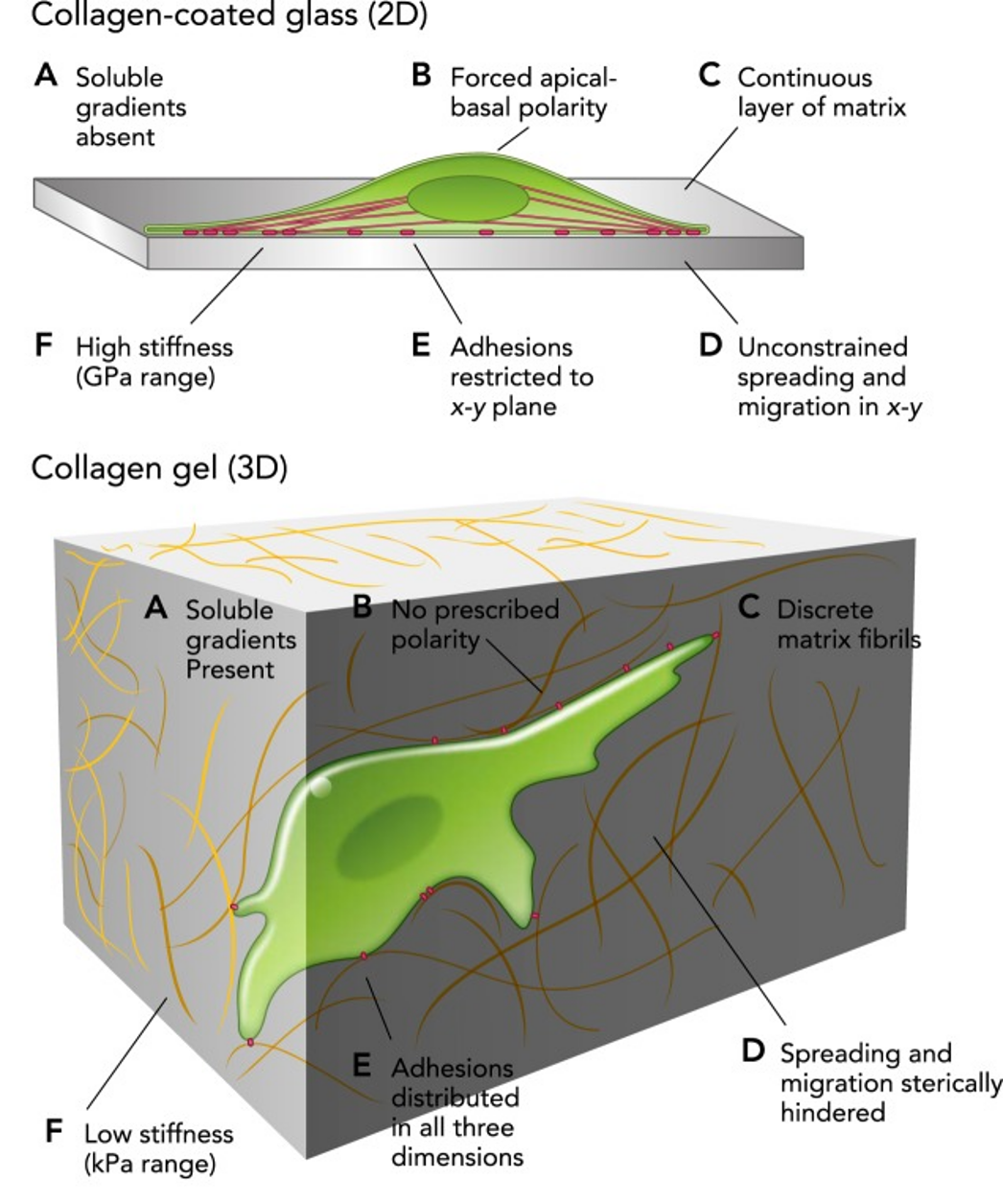
基于支架的3D细胞培养方法的示意
(图片来源于网络)
以目前常用的支架材料基底膜基质(Matrigel)为例,该材料是从富含胞外基质蛋白的EHS小鼠肿瘤中提取的基底膜基质,其主要成分有层粘连蛋白、Ⅳ型胶原、硫酸肝素糖蛋白、巢蛋白,还包含多种生长因子和基质金属蛋白酶等。在室温条件下,Matrigel聚合形成具有生物学活性的三维基质,模拟体内细胞基底膜的结构、组成、物理特性和功能,有利于体外细胞的培养和分化,可用于对细胞形态、生化功能、迁移、侵染和基因表达等研究。
水凝胶是另一种常用的细胞支架材料,由水膨胀性材质构成的高分子网络,用于模拟复杂的细胞外环境。水凝胶材料的关键参数包括孔隙分布、暴露平面区域和孔隙度,其数量和分布会影响细胞渗透入支架的效率。而依据不同的制作工艺,支架具有不同的结构、随机或定制的孔隙分布,支架可以通过包被或功能化以产生不同的特性和影响细胞的生长和行为。
2、无支架3D细胞培养
无支架的3D细胞培养是一种简单、便于操作的细胞培养方法,不需要额外添加细胞支架,而是使用经细胞排斥材质(或称超低吸附材质,ULA)处理的细胞培养器皿或使用悬滴、微流控等特殊系统开展细胞培养,阻止细胞在器皿表面的贴附,迫使其聚集成团形成细胞微球。通过这种方法得到的3D细胞模型具有完整的球体结构,可以自发形成细胞外基质,并良好地模拟体内环境下的氧和营养梯度。
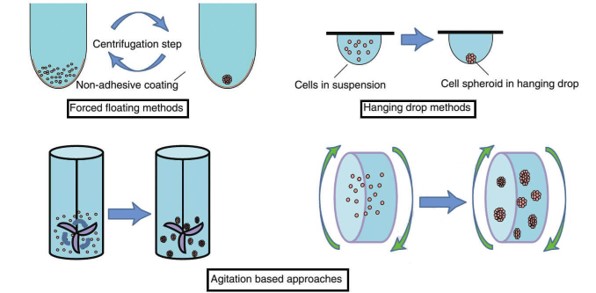
无支架3D细胞培养方法的示意
(图片来源于网络)
超低吸附材质微球培养板是一种常用的无支架3D细胞培养方法,通过超低吸附材质对细胞的排斥,更利于细胞自发聚集成球,并可以直接在培养板中扩大细胞生长不需要转板。通过调整接种的细胞数量,可以控制最终得到的细胞微球大小;使用96孔或384孔板培养细胞的通量更高,可以兼容高通量的3D细胞培养需求。

超低吸附材质微球培养板中细胞聚集成球
(图片来源于InSphero)
悬滴法是另一种常用的方法,使用特殊设计的悬滴板架创建包含了单细胞悬液的小液滴,在无接触的环境下细胞自聚集形成球状体,更利于实验操作,适用于自身较难聚集的细胞类型进行培养。利用悬滴法,只需要几天的时间肿瘤细胞就可以形成类似在体条件的肿瘤微环境,形成若干层细胞层,氧、营养物质、pH和代谢废物等物质的扩散呈现递增或递减的梯度。
使用悬滴法进行培养时悬滴中细胞聚集成球
(图片来源于InSphero)
3D细胞培养过程中常见的技术难点
3D细胞模型的培养方案在十数年的发展过程中不断完善,而更多的技术难点也在不断涌现。此处,我们针对客户最常遇见的一些技术难点进行讨论,并给出相应的曼博生物解决方案。
1、组织解离效率和原代细胞活性丧失
原代细胞(包括胚胎、骨髓、脂肪、肿瘤组织等)是3D细胞培养技术重要的细胞来源,是构建类器官或肿瘤模型的优秀材料。然而组织的解离方案困扰着多数的科研人员,如何高效率的解离组织并尽可能的减少细胞活性的丧失是难以平衡的一大难题。

德国Nordmark Biochemicals公司具有近30年的高质量胶原酶生产和供应经验,提供从科研到GMP级的全线胶原酶,拥有覆盖多物种、多组织的解离方案。解离完成后,曼博自有品牌——泉品,还提供超高性价比细胞过滤筛,具有40、70、100um三个规格,可以方便地搭配50mL离心管使用,助力操作者轻松便捷地获得高质量、高活性的单细胞悬液。
产品网址:https://www.mine-bio.com/Nordmark-Collagenases/
应用介绍:请点击此处了解
2、原代细胞洗涤的细胞损失和活性丧失
经胶原酶解离后的组织细胞需要经过PBS或培养基的洗涤以制备单细胞悬液。通过离心的方法沉淀细胞是目前实验室常用的洗涤方法。但细胞在离心的高引力下会产生应激反应,导致细胞活力下降。并且离心洗涤所带来的细胞聚集也不可忽视,特别是针对从组织中分离得到的原代细胞,由于部分细胞损坏释放了DNA,从而具有很强的粘性,这时用离心法洗涤会将细胞挤压在一起,细胞聚集严重,严重影响细胞留存率,也给后续单细胞悬液的制备增加了难度。

新加坡公司Curiox Biosystems可提供一种完全非离心的洗涤方法——Laminar wash层流洗涤系统,依靠细胞自然沉降的温和层流洗涤替代复杂且可变性高的离心管和微孔板的离心、吹打、弹/吸等操作,节省工作量的同时可保留细胞活力,有效减少细胞聚集,提高细胞留存率。
产品网址:https://www.mine-bio.com/curiox-laminarwash/
应用介绍:请点击此处了解
3、细胞因子活性低导致的细胞培养和类器官诱导生长失败
细胞因子在一些特殊类型细胞或干细胞的培养过程中至关重要,能够促进细胞的生长、修复和分化等。例如肿瘤类器官的培养除了需要基础培养基能否为细胞生长提供必要的营养、生长因子和激素,还需要加入包括相关通路激活剂或者机制及和激素等不同类型的细胞因子来保障肿瘤细胞的生长。细胞因子的主要作用是促进细胞的增殖,如表皮生长因子和成纤维细胞生长因子等是一类基本细胞因子;其他信号通路激动剂R-Spondin1等则在乳腺癌、结直肠癌等肿瘤类器官培养中的必要细胞因子,不仅可以促进肿瘤细胞的增殖还可以控制分泌细胞的分化;肝细胞生长因子等可以特异性促进肝癌细胞的增殖。细胞因子的加入不仅有利于肿瘤类器官的培养,且培养体系更有利于接近体内肿瘤微环境,从而保证体外培养的肿瘤类器官与原发灶肿瘤的生理相关性。
美国Akron Bio公司致力于细胞和基因治疗行业的cGMP辅助材料的生产制造,包括具备安全性、有效性且一致性的高质量重组细胞因子/生长因子、病毒灭活的人源血浆制备的AB血清/人血清白蛋白(HSA25%)、细胞冻存液等产品,并在工业规模上提供高质量的定制开发服务,最终以加速先进的细胞和基因疗法的商业化。
产品网址:https://www.mine-bio.com/Akron-CGT-Ancillary-Materials/
应用介绍:请点击此处了解
4、基质胶难买、难用给实验带来额外烦恼
目前常用的细胞培养支架主要是基质胶,其具有久远的应用历史和众多的文献支持。然而,基质胶是一种取自于动物的天然材料,在使用过程中具有以下这些不可避免的麻烦:
(1)动物福利问题带来的货源短缺;
(2)批间差异大且难以控制,所含的营养物质和蛋白成分受批次影响大;
(3)动物源蛋白和核酸给下游实验的药效评估、荧光检测等环节带来干扰;
(4)基质胶本身的温度敏感特性对储存和操作环节的温度要求严苛……

芬兰上市公司UPM(芬欧汇川集团)是世界先进的跨国森林工业集团之一,旗下的UPM Biomedical部门提供的一种由桦木中提取的纳米纤维纤维素(NFC)和水制成的无动物源成分植物水凝胶(GrowDex),其相比于动物源的基质胶在性能、使用便捷性、批间稳定性、工艺放大稳定性、自动化兼容性等方面具有无可比拟的优势,为科研人员带来全新的3D细胞培养体验。除此之外,该NFC水凝胶成分同时被用于临床促进皮肤移植后伤口愈合用途的敷料(FibDex)获得欧盟CE认证。NFC的生物相容性、高度亲水性,可以为伤口愈合提供有利的湿润环境。
产品网址:请点击此处了解
应用介绍:请点击此处了解
5、ULA板的微球丢失和成像扭曲
无支架3D细胞培养方法得到的细胞模型具有简单的球状三维结构,且可以良好地模拟细胞局部微环境和细胞间的相互作用。市面上常见的超低吸附细胞培养板为了实现更好的细胞聚集效果往往会设计为U型底以减小细胞与板底的接触面积。然而这样的设计为日常操作和细胞成像造成了巨大的影响——培养基更换过程中细胞微球的损伤与丢失,培养基更换不彻底导致的药物浓度不准确,高分辨率细胞成像中出现的图像扭曲变形。

瑞士InSphero公司提供的具有独特设计的超低吸附微球培养板、悬滴细胞培养系统以及细胞培养工具,是其依据3D细胞培养过程中的痛点问题研发和设计的,可以实现多种类型细胞微球的形成、长时间周期的培养和观察、简便彻底的培养基更换、清晰真实的高分辨细胞成像,是一种便捷、高通量、更具洞悉力的三维模型解决方案。
产品网址:https://www.mine-bio.com/InSphero/
应用介绍:请点击此处了解
6、高通量3D细胞模型药物筛选中的效率低下和数据一致性差
随着药物研发需求的日益增长,药企在药物研发过程中越来越青睐选择筛选周期短、易于实现高通量和自动化以及临床相关性强的药物筛选模型。其中3D细胞培养生成的药筛模型,在结构以及功能上高度模拟人体器官,更贴近人体真实的体内环境,具有更强的临床相关性。相比较依赖于小鼠的PDX模型,更是具有筛选周期短,通量高的优势。然而,在传统的研发模式中,由于严重依赖人工操作,存在通量低、手法差异大、误差难避免等问题。同时,高额的人力成本投入造成的人才资源的浪费也使得众多药企和研究单位开始重视自动化流程的搭建。

德国Dispendix公司提供的非接触式纳升级分液系统,I-DOT(Immediate Drop-on-demand Technology)是经过优化和验证过的技术,使用非接触式压力喷射技术,可实现纳升到微升范围微量液体的精准快速分液。I-DOT 可以分配多种溶液种类,包括各类水相缓冲液、蛋白溶液、DMSO(100%)、甘油(50%)、活细胞、3D微球等。使用I-DOT进行3D细胞球初始细胞的接种,可实现快速高通量、更均一的细胞悬液分配,且分配过程不会对细胞活力产生影响。I-DOT作为一个纳升级非接触式分液设备,还可实现不同浓度的药物溶液以及多种药物组合的快速高通量分配,帮助解决药筛流程的快速以及高通量问题。
产品网址:https://www.mine-bio.com/dispendix-I-DOT/
应用介绍:请点击此处了解
7、静态培养无法模拟体内的血流刺激带来的物理力刺激微环境
尽管3D培养获得的微组织相比于2D培养的单层细胞,在形态和功能上都有极大的改善。但由于缺乏模拟体液循环,使得依赖于液体循环的分子交换(蛋白,糖类,脂质,氧气,代谢产物等)和多器官之间的信号交流无法得以很好地实现。同时忽略了表面张力、压力和剪切力等物理力在微环境中的重要性,细胞的生长极性和部分功能缺失。有研究表明,合适的湍流形成的剪切力更容易诱导iPSC细胞大规模产生血小板,毛细管样的平流使得原代肝脏类器官组织可在体外培养长达4周并维持良好的极性,较高的健康程度和代谢酶活性。

来自MIT的微流控器官芯片系统Physiomimix(CN Bio)为体外模拟体内的微组织3D培养提供了完美的解决方案。针对不同组织设计的芯片物理结构提供每种组织独特的生长空间,组织特异性优化的液流循环实现了组织内部的营养、气体和代谢废弃物的更换,提供了组织极性和功能性自组装所需的剪切应力,以及使得多组织之间的信号串扰得以获得良好的研究手段。在肠道吸收,肝脏解毒和代谢等药物研发领域以及疾病模型(病毒体外感染模型,非酒精性脂肪肝模型等)上获得了更接近临床人体反应的真实数据结果,是静态3D培养和动物实验无法比拟的。
产.品网址:https://www.mine-bio.com/CN-Bio-Innovations/
应用介绍:请点击此处了解