发布时间:2023/08/07 点击数:
发布时间:2023/08/07 点击数:概述
肺是由于持续暴露于环境中吸入的颗粒物和病原体,而变得对感染和损伤最为脆弱的内脏器官。与此同时,呼吸道疾病成为了导致死亡和致残的主要原因之一。在全球导致预期寿命减少的十个主要因素中,呼吸道疾病占据了三个位置,分别为慢性阻塞性肺疾病(第三位)、下呼吸道感染(第四位)和肺癌(第六位)(参考《世界卫生组织全球卫生估计》,2020年)。而且,这种状况在COVID-19疫情的冲击下变得更加严峻,这一全球疫情导致了广泛的疾病和死亡。
然而,令人遗憾的是,进入市场的新型肺部治疗药物的比例仅为3%,而其他疾病治疗药物的比例则在6-14%之间(Barnes等人,2015年)。这一差距在一定程度上可以归因于现有预临床模型的不足。这些模型存在多方面的问题,包括高昂的成本、不道德的非人体内实验,以及过于简化的体外模型,无法真实地再现人类肺部生物学和免疫学的复杂性以及微小的变异。因此,亟需开发新的预临床模型,能够精确地模拟人类肺部的特性,并能够准确预测对新型治疗方法的反应。
本应用说明详细描述了由英国创新科技基金(Innovate UK)资助的两种肺部芯片(亦称微生理学系统MPS)的开发,以应对上述问题。这些芯片的设计目标是模拟人类肺部,弥补现有模型的不足之处。为了实现这一目标,我们利用PhysioMimix单器官系统和多孔板构建了肺泡和支气管气道模型,与传统的静态24孔条件下的气液界面(ALI)培养进行了比较。通过在流体灌注的Transwell底部引入原代人类肺微血管内皮细胞,我们增加了肺MPS模型的复杂性。同时,加入单核细胞,可以在支气管模型的底侧模拟循环免疫细胞,或者在肺泡模型的顶侧模拟类似肺泡巨噬细胞的细胞。所有这些改进使多细胞类型MPS模型能够准确地模拟人类肺组织,呈现出与相关组织结构和细胞分化一致的特点。
为了验证这些模型在呼吸道感染研究和开发中的应用潜力,我们使用表达SARS-CoV-2 Spike蛋白的假型化慢病毒对这些模型进行感染,以模拟COVID-19感染情况。感染和随后的炎症反应得以绘制,与COVID-19患者的炎症指标进行了比较,从而验证了该模型的相关性。我们还使用了一种针对SARS-CoV-2 Spike受体结合结构域(RBD)的中和单克隆抗体,观察了其对感染的抑制效果,并发现该模型对这种治疗呈现出剂量依赖性的响应。这些数据充分证明了该模型在预测抗SARS-CoV-2疗效方面的能力,并为我们更好地理解COVID-19疾病的进程提供了有力支持。
方法
为了培养原代人类小气道或支气管上皮细胞,使用Transwell在24孔板(静态条件)或PhysioMimix多孔板(灌流条件)上进行ALI(空气液体界面)培养,持续14天(见图1)。使用显微镜观察培养细胞,利用qPCR分析细胞分化情况。对于肺泡培养,使用抗体(显微镜观察)或Taqman引物(qPCR)检测肺泡I型细胞(ATI)标志物(水通道蛋白5,AQP5)和肺泡II型细胞(ATII)标志物(肺表面活性蛋白B,SFTPB)。对于支气管培养,使用相同的检测方法检测痰腺细胞(粘蛋白5AC,MUC5AC)、纤毛细胞(Forkhead盒蛋白J1,FOXJ1,或乙酰化α-管蛋白)和腺体细胞(分泌球蛋白家族A1成员1,SCGB1A1)标志物。
将原代人类肺微血管内皮细胞加入Transwell的底侧,与上皮细胞共培养。在肺泡和支气管培养中,添加THP-1单核细胞到底侧以模拟循环单核细胞。在肺泡培养中,还将THP-1细胞添加到顶侧以模拟肺泡巨噬细胞(见图1)。为了测试共培养炎症反应,细胞接受脂多糖或聚(I:C)的刺激。在48小时内收集来自底侧的培养基样本,并通过ELISA分析IP-10/CXCL10的分泌情况。
应用携带mCherry标签的表达SARS-CoV-2 Spike(D614G)蛋白的假型化慢病毒来模拟COVID-19研究,将其施加到模型的顶侧,持续48小时。在48小时感染过程中,收集来自模型底侧的培养基样本,然后固定组织,并使用抗SFTPB抗体、鬼笔草酮和DAPI染色。通过共聚焦显微镜分析组织,以确定感染效率。将单核细胞标记为CellTracker Far Red染料,并加入培养中,以确定感染过程中的免疫细胞相互作用。通过ELISA分析培养基样本中的IL-1β和IL-6的分泌情况。
为了确定该模型预测COVID-19疗效的能力,使用针对Spike RBD的中和单克隆抗体,并比较感染情况,持续48小时。在48小时感染过程中,收集来自模型底侧的培养基样本,然后固定组织,并使用鬼笔草酮和DAPI染色。通过ImageJ/Fiji计量感染细胞数量。
肺 MPS培养图
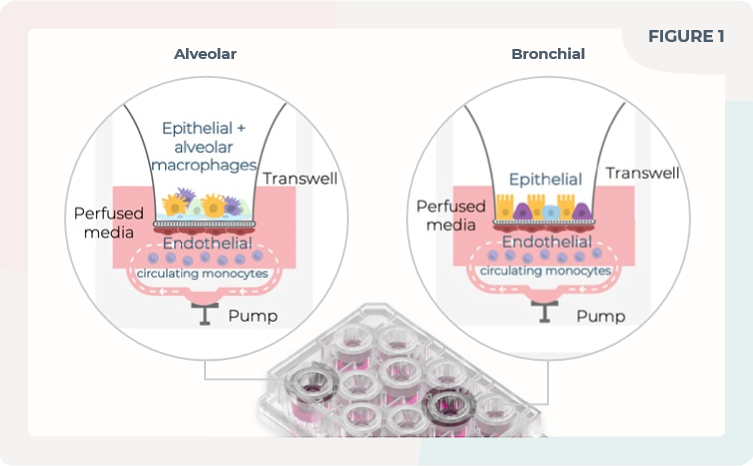
图1. 肺泡和支气管MPS模型的可视化表示
使用CN Bio的PhysioMimix单器官系统,在Barrier板中制作了肺泡和支气管MPS模型。在肺泡模型中,上皮细胞和THP-1单核细胞(肺泡巨噬细胞)被共同培养在插入器的顶侧。在支气管模型中,只有上皮细胞被培养在插入器的顶侧。在这两种模型中,肺内皮细胞被培养在插入器的底侧,而THP-1单核细胞则在灌流培养基中循环。
结果
通过Innovate UK授予的资金,CN-bio团队开发了两种肺芯片模型,用于复制肺泡和支气管气道,用于呼吸道感染研究和药物开发。与传统的ALI培养细胞相比,灌流模型展示出更好的组织形成,并分化成人类肺部各个区域的关键细胞类型(见图2)。肺泡MPS组织形成类似肺泡囊状结构,并呈现出ATI和ATII细胞的细胞标志物(见图2 A)。其他原代细胞或MPS模型往往会构建偏向ATI细胞的组织,这是由于ATII细胞向ATI细胞的转分化造成的细胞压力的迹象,然而,这里没有检测到仅ATI表型的细胞偏向(见图2 B)。支气管MPS形成多层伪层状上皮组织,比静态培养的组织更厚更极化(见图2 D)。细胞分化成各种支气管细胞类型,包括具有功能性相关性的多纤毛细胞和分泌粘液的细胞(见图2 C)。
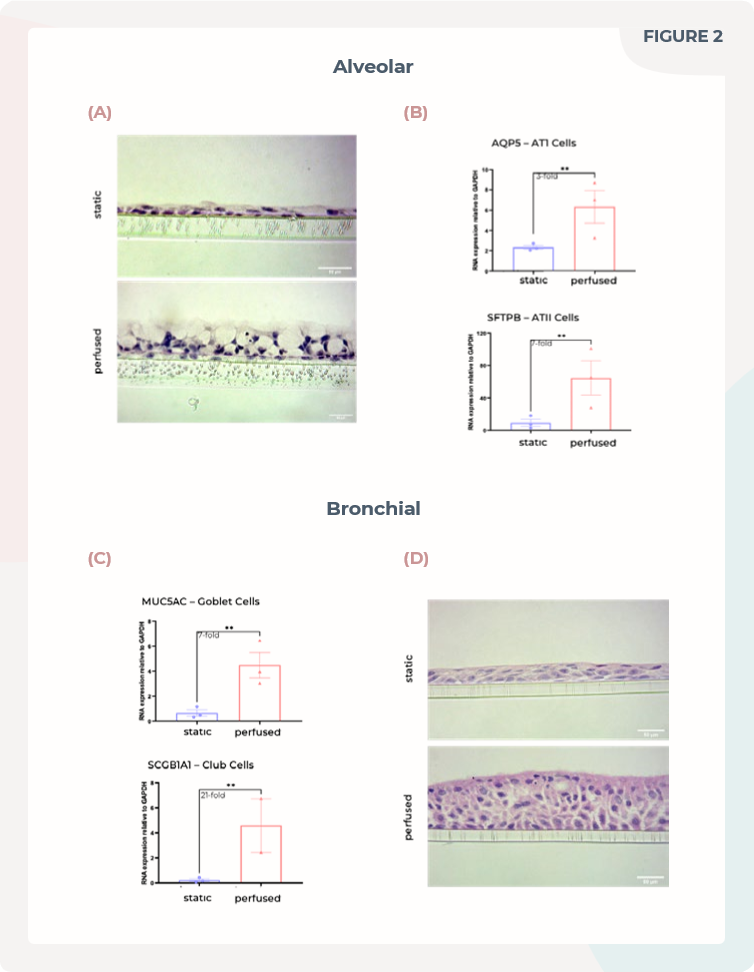
图2. 在MPS中培养的肺泡和支气管细胞显示出较好的组织形成,并分化成生理学上相关的细胞表型。
(A)肺泡组织被切片,并使用H&E染色进行可视化。
(B)对肺泡培养中AQP5(AT1细胞)或SFTPB(ATII细胞)的表达进行qPCR分析。
(C)对支气管培养中MUC5AC(痰腺细胞)或SCGB1A1(腺体细胞)的表达进行qPCR分析。
(D)支气管组织被切片,并使用H&E染色进行可视化。刻度尺为50μm。
通过引入肺微血管内皮细胞,进一步提升了模型与生理学的相关性。这些细胞与物理和化学信号相互作用,增强了模型的复杂性(见图3)。我们通过引入单核细胞,突显了模型的免疫竞争力。这些细胞在培养基的基底侧进行循环,或者与肺泡上皮细胞在顶侧进行共培养,模拟肺泡巨噬细胞的情景(见图3)。在受到Toll样受体激动剂挑战时,MPS模型表现出多样的炎症反应,与体内和体外数据一致(参考Errea等人,2015年;Ritter等人,2005年)。支气管MPS培养对LPS没有反应,这可能与其缺乏TLR4受体有关。引入单核细胞后,支气管培养对LPS挑战产生了炎症反应(见图3 B)。肺泡培养对两种挑战都做出了反应,但在模拟病毒感染挑战后观察到更强烈的炎症反应(见图3 C)。
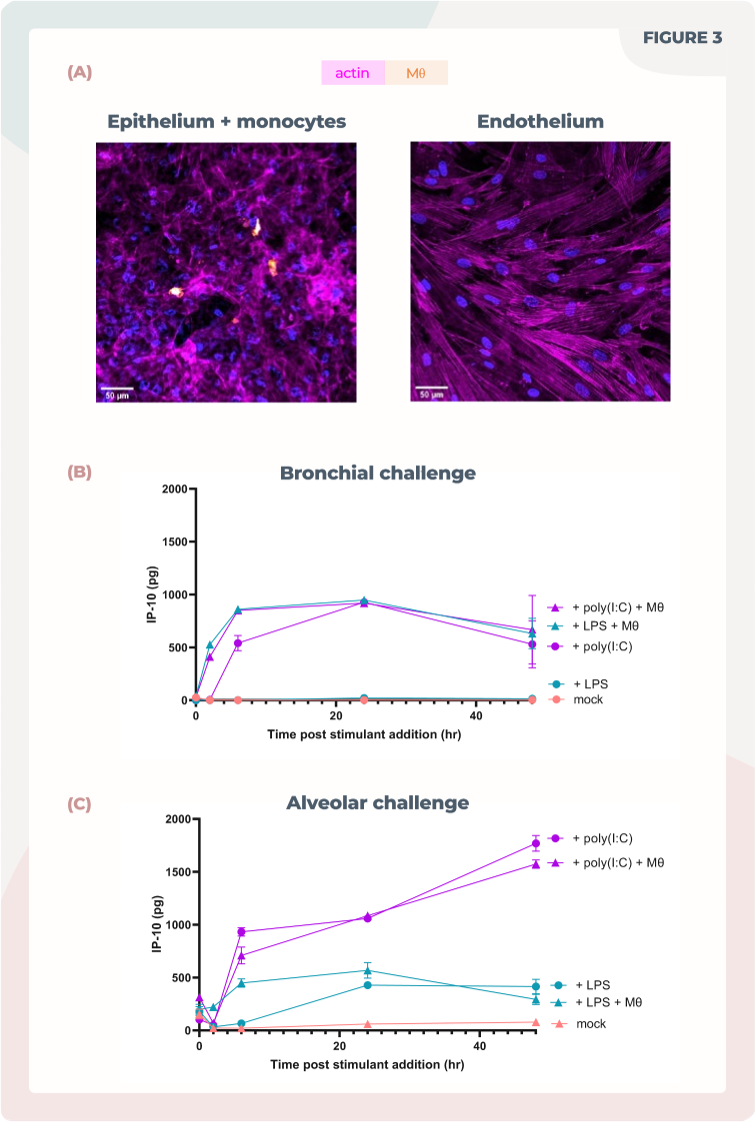
图3. 加入内皮细胞和单核细胞使得对不同炎症反应进行绘制成为可能。
(A)肺泡模型中细胞层的共聚焦图像,上皮细胞和单核细胞(Mθ)位于顶侧(上方),内皮细胞位于底侧(下方)。单核细胞被标记为CellTracker Far Red(橙色),所有细胞被使用鬼笔草酮染色(品红色)和DAPI染色(蓝色)。刻度尺为50μm。
(B)支气管共培养模型中,含有或不含单核细胞(Mθ)的细胞受到LPS或poly(I:C)的刺激,使用ELISA分析48小时内的IP-10表达。
(C)肺泡共培养模型中,含有或不含单核细胞(Mθ)的细胞受到LPS或poly(I:C)的刺激,使用ELISA分析48小时内的IP-10表达。
肺MPS模型在COVID-19研究中的实际应用性已经得到验证。
首先,我们测定了肺MPS中SARS-CoV-2受体蛋白ACE2和TMPRSS2的表达水平,并确定其表达水平与人类肺部患者相似(参考Hou等人,2020年,见图4A)。
接着,我们应用了带有mCherry标签的假型化SARS-CoV-2 Spike(D614G)蛋白的慢病毒来感染培养模型。这两种模型都成功地受到了慢病毒感染,并表现出与生理情况相关的炎症反应。在感染区域,肺泡巨噬细胞样细胞聚集,并分泌关键的细胞因子,如TNFα、IL-1β和IL-6。这些细胞因子在COVID-19患者中通常升高,这为模型的可靠性提供了有力的支持(参考Del Valle等人,2020年;Huang等人,2020年)。
图4 B-D显示了感染后的炎症反应情况,进一步验证了我们肺MPS模型在研究COVID-19方面的潜力。
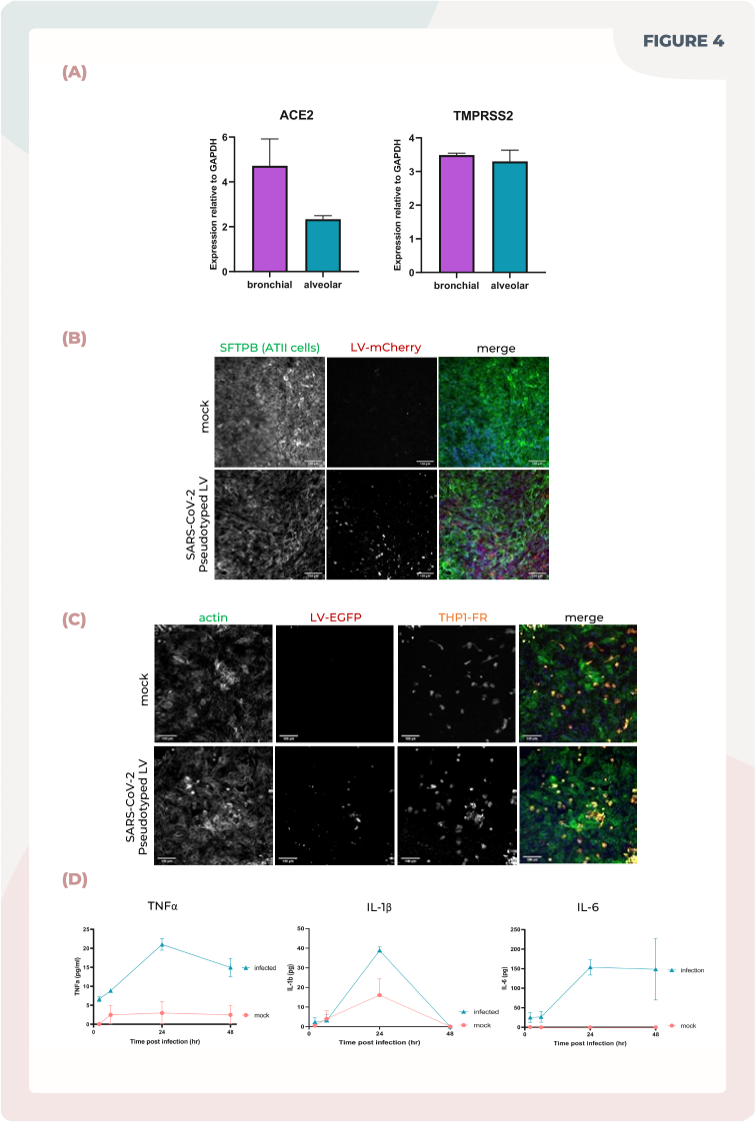
图4. 肺MPS受到SARS-CoV-2感染并产生炎症反应。
(A)使用qPCR测量肺泡和支气管MPS培养中ACE2和TMPRSS2的mRNA表达。
(B)使用携带mCherry标签的表达SARS-CoV-2 Spike(D614G)蛋白的假型化慢病毒感染肺泡培养。组织被固定并使用SFTPB(绿色)、DNA(蓝色)和mCherry(红色)染色。刻度尺为100μm。
(C)使用携带mCherry标签的表达SARS-CoV-2 Spike(D614G)蛋白的假型化慢病毒感染带有THP-1单核细胞的肺泡培养(THP-1单核细胞用橙色Cell Tracker标记)。组织被固定并使用mCherry(红色)、肌动蛋白(绿色)和DNA(蓝色)染色。刻度尺为100μm。
(D)在感染过程中,使用ELISA测量TNFα、IL-1β和IL-6的表达情况,持续48小时。
为了验证肺MPS在COVID-19药物研发中的潜力,我们将针对Spike蛋白的单克隆抗体引入模型,并在感染过程中使用了三种不同的剂量浓度(0.05、0.5和5μg/ml)。结果显示,在剂量依赖性的情况下,这些单克隆抗体成功地抑制了肺MPS的感染,从而证实了肺MPS用于验证COVID-19治疗药物疗效的实际可行性(见图5)。将这些肺MPS模型纳入制药工作流程将会加速药物候选物的筛选过程,从而实现更快、更经济高效和可靠的药物研发。这种方法能够更迅速地应对新型病原体的威胁,为疾病的控制和治疗提供有力支持。
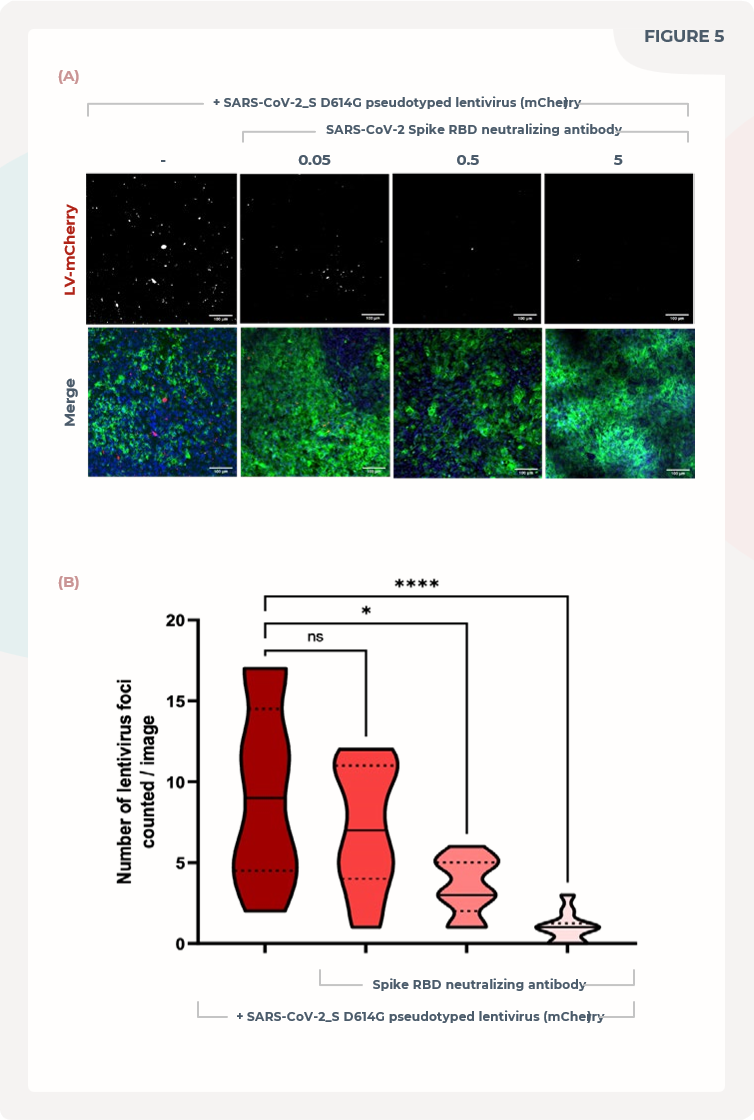
图5. 肺MPS预测COVID-19中和抗体的疗效。
(A)肺泡培养模型被孵育在不同浓度的针对Spike RBD的单克隆抗体中(0.05、0.5、5 µg/ml),然后使用携带mCherry标签的表达SARS-CoV-2 Spike(D614G)蛋白的假型化慢病毒感染。培养模型在感染后孵育48小时,然后进行固定并使用肌动蛋白(绿色)、DNA(蓝色)和mCherry(红色)染色。刻度尺为100μm。
(B)每个图像的感染灶数量(每个条件下共10张图像)。
讨论
COVID-19大流行向全球呼吁警钟,警示着新兴病原体及其不断演化的威胁。为了迎接这一挑战以及未来可能出现的威胁,必须采用更为准确的方法来模拟和预测疾病情况。在这方面,肺MPS模型成为了一项有力的解决方案。这两种肺MPS模型在模拟人类肺部方面表现出色,对病原体感染展现出与人类相关的炎症反应。通过对组织和细胞培养基的分析,我们能够深入理解导致疾病的生物学机制,同时预测人类对用于治疗疾病的药物的反应。肺MPS模型为迅速确定和验证临床药物候选品提供了解决方案,这将使我们能够以更加精准的方式来应对新兴疾病。
肺MPS模型的应用为我们在面对新兴病原体时提供了强有力的工具,促使我们更加精确地理解疾病的发展机制,更有效地开发治疗药物,从而确保我们能够迅速而准确地应对未来可能的健康威胁。
总结
· 肺泡和支气管MPS肺模型已经被开发出来,以更精确地模拟人类肺部。
· 肺MPS组织可以由上皮细胞、内皮细胞和免疫细胞组成的共培养形成。
· 肺泡和支气管MPS形成具有生理相关结构和细胞组成的组织。
· 肺MPS已经验证用于COVID-19研究,并可应用于其他传染性肺部疾病研究。
· 使用肺MPS可加快对临床前研究药物候选的资格认定。
· 这两种肺MPS还可以通过PhysioMimix多器官系统和双器官板与预测性的人类肝模型(肝MPS或肝芯片)进行流体相互连接,以进一步研究疾病和治疗干预过程中的炎症机制和器官之间的相互影响。
参考文献
Barnes, P. J., Bonini, S., Seeger, W., Belvisi, M. G., Ward, B., & Holmes, A. (2015).Barriers to new drug development in respiratory disease. In European Respiratory Journal (Vol. 45, Issue 5, pp. 1197–1207). European Respiratory Society.https://doi.org/10.1183/09031936.00007915
Del Valle, D. M., Kim-Schulze, S., Huang, H. H., Beckmann, N. D., Nirenberg, S., Wang, B., Lavin, Y., Swartz, T. H., Madduri, D., Stock, A., Marron, T. U., Xie, H., Patel, M., Tuballes, K., Van Oekelen, O., Rahman, A., Kovatch, P., Aberg, J. A., Schadt, E., … Gnjatic, S. (2020). An inflammatory cytokine signature predicts COVID-19 severity and survival. Nature Medicine, 26(10), 1636–1643. https:// doi.org/10.1038/S41591-020-1051-9
Errea, A., González Maciel, D., Hiriart, Y., Hozbor, D., & Rumbo, M. (2015). Intranasal administration of TLR agonists induces a discriminated local innate response along murine respiratory tract.
Immunology Letters, 164(1), 33–39. https://doi.org/10.1016/J.IMLET.2015.01.004
Hou, Y. J., Okuda, K., Edwards, C. E., Martinez, D. R., Asakura, T., Dinnon, K. H., Kato, T., Lee, R. E.,
Yount, B. L., Mascenik, T. M., Chen, G., Olivier, K. N.,Ghio, A., Tse, L. V., Leist, S. R., Gralinski, L. E., Schäfer, A., Dang, H., Gilmore, R., … Baric, R. S. (2020). SARS-CoV-2 Reverse Genetics Reveals a Variable Infection Gradient in the Respiratory Tract. Cell, 182(2), 429-446.e14. https:// doi.org/10.1016/J.CELL.2020.05.042
Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., Zhang, L., Fan, G., Xu, J., Gu,X., Cheng, Z., Yu, T., Xia, J., Wei, Y., Wu, W., Xie, X., Yin, W., Li, H., Liu, M., … Cao, B. (2020). Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet (London, England), 395(10223), 497–506. https://doi. org/10.1016/S0140-6736(20)30183-5
Ritter, M., Mennerich, D., Weith, A., & Seither, P. (2005). Characterization of Toll-like receptors in primary lung epithelial cells: strong impact of the TLR3 ligand poly(I:C) on the regulation of Toll-like receptors, adaptor proteins and inflammatory response. Journal of Inflammation (London, England), 2.
https://doi.org/10.1186/1476-9255-2-16

PhysioMimix Organ-On-Chip采用微流控技术,将不同类型的细胞和组织以三维结构排列在芯片内,同时模拟相关的流体和环境条件,以更真实地模拟器官的功能和相互作用。
它可以模拟多个器官系统,并允许研究人员研究和评估药物的吸收、代谢、毒性和效果,以及研究器官之间的相互作用和疾病的发展机制。
目前这个系统有三种型号:单器官标准版、单器官高通量版具有更高的通量、多器官标准板在单器官标准版的基础上多兼容了双器官板。
为什么要选择PhysioMimix呢?
第一点,这个系统一体式的紧凑结构,可以很容易的放在实验室桌面上,而且与现有设备兼容;
第二点,这个设备可以让用户在不到1分钟的时间内设定程序并运行;
第三点,它的开放性孔设计支持您2D到3D细胞培养过渡,像屏障芯片板还可以放入商业化的transwell;
第四点,可以让您在整个过程中随时取样进行分析;
第五点,可以以最少的用户介入进行长期的自动化实验;
第六点,兼容一系列预先形成的组织和细胞类型;
第七点,可以通过微流体连接两个器官,从而研究期间的串扰;
第八点,更多的实验孔意味着每颗芯片孔的成本得以降低;
第九点,板内设置的对照孔或者副孔意味着数据的置信度可以提升;
第十点,更强的处理能力使整个过程可以更早的洞见数据。