发布时间:2023/09/06 点击数:
发布时间:2023/09/06 点击数: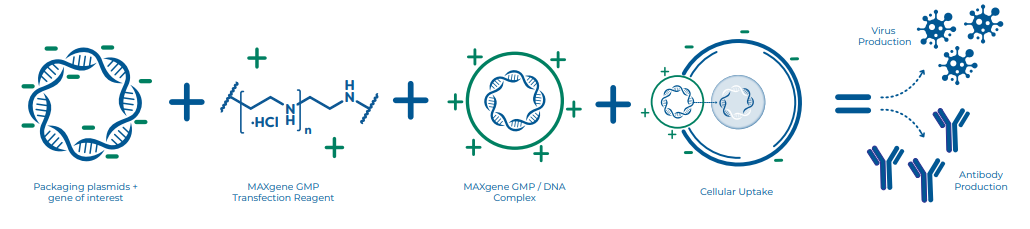
前言
近年来,随着许多与疾病和细胞过程相关的基因被确定为治疗的潜在靶点,生物疗法已成为很多疾病的有效治疗方法。据估计,每年都有数百种生物疗法候选药物被开发出来。
基因治疗与细胞治疗都属于生物疗法范畴。基因治疗是将转基因材料转移到患者的组织或细胞中,达到纠正异常基因引起的特定疾病的目的。细胞治疗是指采用生物工程的方法获取具有特定功能的细胞,并通过体外扩增、特殊培养等处理后,使这些细胞具有增强免疫、杀死病原体和肿瘤细胞等功能,从而达到治疗某种疾病的目的。然而,如何实现高效的基因递送是开发生物疗法药物的关键限制因素之一。目前,病毒载体,例如腺相关病毒(AAV)和慢病毒(LV)载体等已成为生物疗法中常用的递送工具,已被证明拥有较高的安全性和高效的靶向递送能力。
AAV能够穿透细胞膜从而将外源核酸分子引入到靶细胞中,并且AAV与目前已知的人类致病性疾病无关,能够有效的作为递送载体将目标核酸分子递送给患者。慢病毒载体作为另一种选择,能够容纳更大的目标因子,同时能够整合到宿主基因组中实现长期表达。目前,新一代的慢病毒载体也在越来越多的临床应用中表现出很低的安全性问题。此外,这些病毒载体还能够将目标核酸分子引入到特定的宿主位点,从而实现高度特异性的表达。但是,病毒载体的获取一直以来受到多方面因素的影响,转染试剂便是其中的一个重要因素,极大的影响着转染效率的高低,是决定最终病毒滴度的重要一环。目前市面上有很多不同的转染试剂可供选择,但很难评估和找到一个能够在临床和研究中同时兼具高效性和低毒性的转染试剂。
Polysciences PEI
聚乙烯亚胺(PEI)作为体内外基因递送的金标准转染试剂,已有悠久的历史。PEI是一种阳离子聚合物,可以与核酸形成带正电荷的复合物,该复合物容易和细胞表面相互作用,通过细胞内吞作用转运到细胞质中,最终使PEI/核酸复合物递送到细胞核。PEI介导的转染比其他方法更具有优势,首先PEI在不同的细胞类型中都具有良好的耐受性,包括用于生物加工的细胞系;其次,PEI对于贴壁和悬浮细胞培养体系都具有低毒性和相容性。
Polysciences 提供高品质的科研级和cGMP级转染试剂,用于病毒载体/蛋白质工艺开发到临床试验以及商业化生产的平稳过渡。Polysciences 成立于1961年,凭借其长期制造独特、高品质的特种化学品的悠久历史,已经成为众多开发基因/细胞治疗产品知名企业值得信赖的合作伙伴。Polysciences 的科研级PEI MAX已被学术和工业客户使用了十多年,是引用最多的转染试剂之一。几年前,Polysciences推出了一款易于使用的液体版本的PEI MAX,命名为Transporter 5,专注于提高使用的便利性。PEI MAX和Transporter 5均可以用于工艺开发。根据FDA指南开发临床级产品涉及多个要素,拥有cGMP级原材料是确保病毒疗法安全性和最终患者安全的最关键因素之一。2019年,Polysciences 根据美国FDA GMP指南推出了一款cGMP转染试剂。除了cGMP指南外,Polysciences还执行质量控制程序,使MAXgene GMP成为符合高质量标准的经济型转染试剂,且作为用于人体临床试验和商业化的治疗性病毒载体生产的原料。MAXgene GMP完成了PEI产品用于病毒载体工艺开发到商业化的无缝过渡。使用MAXgene GMP进行病毒载体的放大可以确保与使用科研级PEI MAX和Transporter 5 进行小规模工艺开发/临床前试验的产量相当。
插播一则活动速报!科研伙伴看过来!免费试用火热进行中↓↓↓

(点击上方橙色文字可一键跳转至官网活动详情页~)
工艺开发到商业化生产过程
生物工艺生产放大顺序

Polysciences 的PEI转染试剂具有许多优势,使其成为细胞/基因治疗药物生产商进行工艺开发、临床试验和商业化生产值得信赖的选择。
1. 高品质R&D和cGMP级的选择
2. 高转染效率,兼顾低毒性
3. 高度可重复性的病毒/蛋白质产量(从培养皿到大规模生物反应器)
4. 适用于稳定和瞬时转染
5. 所有材料均在来源于美国,符合ISO 13485质量体系标准
6. 高性价比
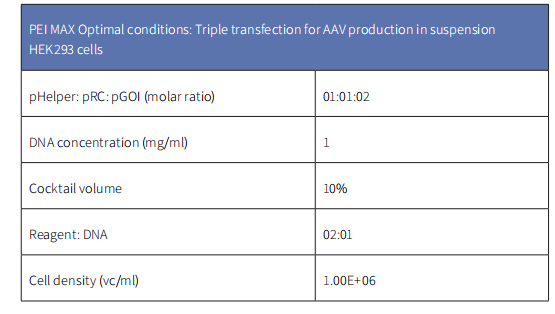
获得高转染效率的最佳PEI/DNA比例可能因细胞类型和其他检测参数的差异有所不同。Gu等人对某品牌的转染试剂和polysciences 的PEI MAX在三重转染悬浮HEK293细胞中生产AAV进行了比较分析,结果显示,使用PEI MAX所生产的病毒滴度相较该转染试剂增加了约3倍,具体使用参数如下:
01 高度可重复性
Polysciences 的线性PEI被广泛引用,PEI MAX和Transporter 5被设计用于病毒载体研发和工艺开发过程,对于临床试验和商业化,polysciences 推荐使用MAXgene GMP,它有粉末和液体两种形式,满足基因/细胞治疗原料的质量和监管要求。这三种产品都是完全水解的,易于操作且提供更高的转染效率。
Polysciences PEI产品不同批次保持高度一致性。
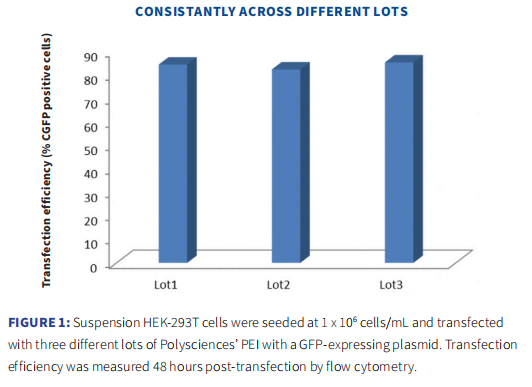
3个不同批次的PEI转染试剂将表达GFP的质粒转染到悬浮HEK-293T细胞中,转染后48h,通过流式细胞术检测转染效率,结果表明,3个不同批次的PEI的转染效率没有显著差异。
02 低细胞毒性
转染后的细胞状态极大的影响着最终的产毒量,选择适合的转染试剂能够尽可能的减少因转染试剂导致细胞受损造成的细胞产毒能力不足。Polysciences转染试剂具备高效的转染能力,同时兼顾低毒性,能够有效避免对细胞的损伤。
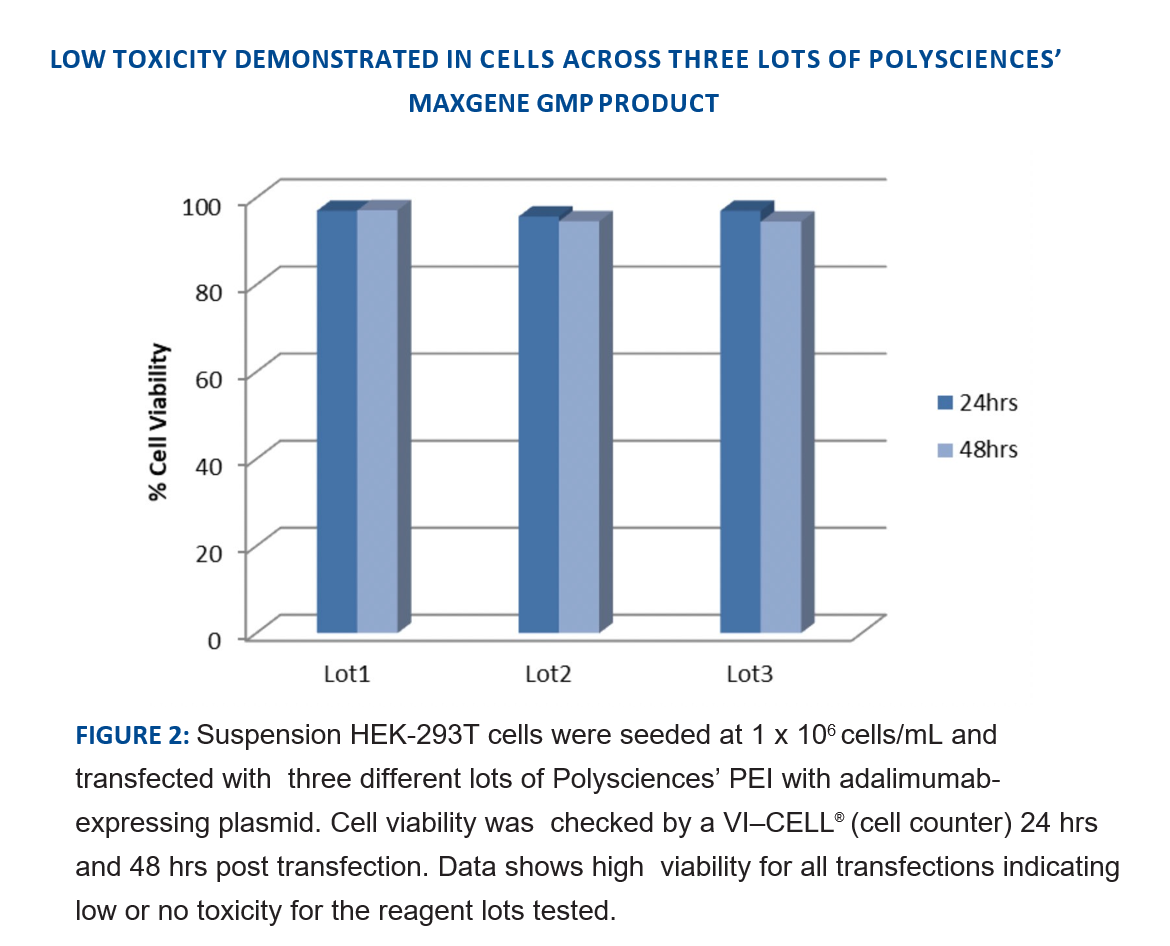
三个不同批次的Polyciences PEI转染悬浮HEK-293T细胞表达单抗,使用VI-CELL细胞计数仪检测转染后24h和48h的细胞活性。数据显示,所有细胞的活力均在90%以上,表明3个不同批次的均保持低毒性,且保持批次间一致性。
03 高滴度
优化所有protocol参数以产生高效的生物过程是至关重要的。选择适合的转染试剂尤其重要,因为它对整个过程和最终产品的收率有重大影响。
研究发现,使用polysciences的PEI转染试剂,转染效率高,细胞毒性低。PEI MAX几乎完全去乙酰化,这有助于提高转染效率,同时使其成为一种细胞毒性更小的转染试剂,也有研究证明利用PEI MAX在大型生物反应器中可以获得高滴度的AAV。
Polysciences PEI MAX产生高滴度AAV病毒
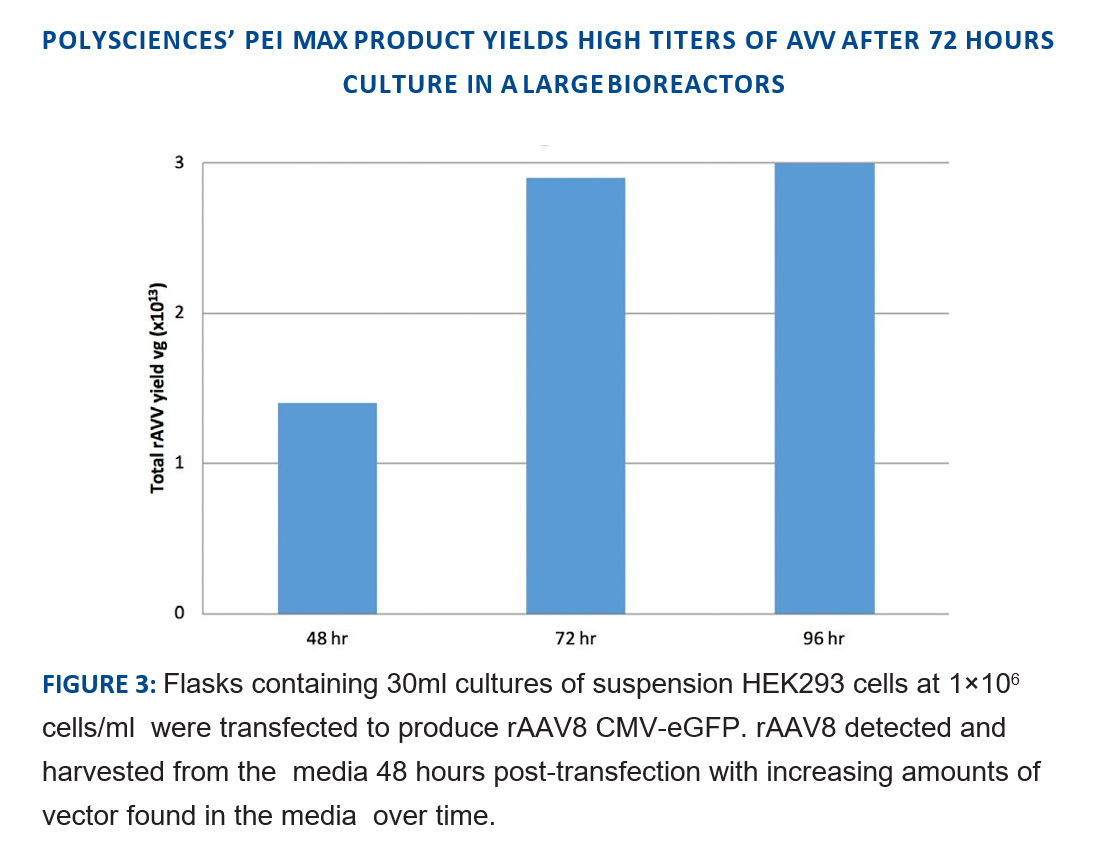
Polysciences PEI MAX转染悬浮HEK293细胞生产rAAV8(CMV-eGFP),转染后48h、72h和96h分别收样,检测rAAV8的产量,结果表明随着时间的增加,表达量逐渐增加。
04 可拓展性和灵活性
Polysciences的PEI转染试剂适用于各种细胞系和细胞类型。稳定和瞬时转染都可用,在贴壁和悬浮培养中均可产生高产量病毒/蛋白。
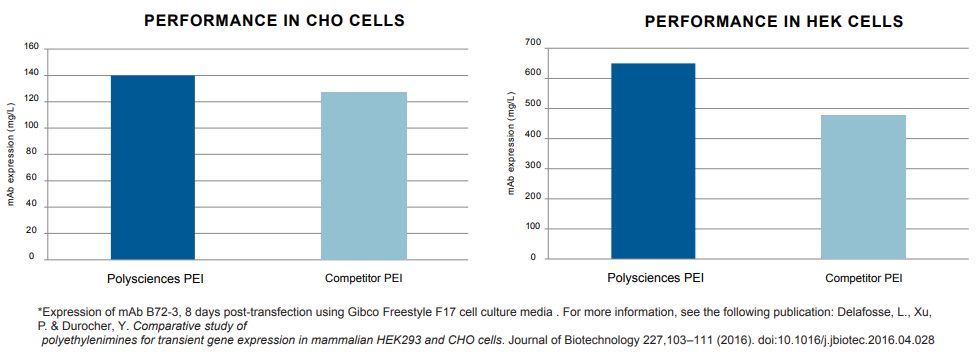
由于许多病毒/蛋白的制造工艺使用HEK293细胞和CHO细胞,这里我们提供了polysciences PEI和竞争对手的PEI在这两种细胞中的性能比较数据。
Polysciences PEI转染试剂产生更高的抗体:
结论
生物疗法已成为一系列疾病的有效治疗方法,在研究最终的生物疗法时,重要的是回顾整个开发过程。在保持质量和一致性的基础上,持续不断的开发,最终产生对患者安全有效的生物治疗药物是至关重要的。作为细胞/基因治疗企业十多年来的重要合作伙伴,Polysciences 了解这一连续过程,也了解客户从早期阶段到关键试验和最终药物交付给患者持续开发过程中对优质原材料的需求。
参考文章
1. Aravindan, L., Bicknell, K. A., Brooks, G., Khutoryanskiy, V. V., & Williams, A. C. (2009). Effect of acyl chain length on transfection efficiency and toxicity of polyethylenimine. International journal of pharmaceutics, 378(1-2), 201-210.
2. Dai, Z., Gjetting, T., Mattebjerg, M. A., Wu, C., & Andresen, T. L. (2011). Elucidating the interplay between DNA-condensing and free polycations in gene transfection through a mechanistic study of linear and branched PEI. Biomaterials, 32(33), 8626-8634.
3. Daya, S., & Berns, K. I. (2008). Gene therapy using adeno-associated virus vectors. Clinical microbiology reviews, 21(4), 583-593.
4. Delafosse, L., Xu, P., & Durocher, Y. (2016). Comparative study of polyethylenimines for transient gene expression in mammalian HEK293 and CHO cells. Journal of biotechnology, 227, 103-111.
5. Durymanov, M., & Reineke, J. (2018). Non-viral delivery of nucleic acids: Insight into mechanisms of overcoming intracellular barriers. Frontiers in pharmacology, 9, 971.
6. Grieger, J. C., Soltys, S. M., & Samulski, R. J. (2016). Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Molecular Therapy, 24(2), 287-297.
7. Gu, B., Bhat, V., Dong, W., Pham, H., Pubill, S., Kasaraneni, N., ... & Seth, A. (2018). Establishment of a scalable manufacturing platform for in-silicoderived ancestral adeno-associated virus vectors. Cell and Gene Therapy Insights, 4(S1), 753-769.
8. Milone, M. C., & O’Doherty, U. (2018). Clinical use of lentiviral vectors. Leukemia, 32(7), 1529-1541.
9. Naso, M. F., Tomkowicz, B., Perry, W. L., & Strohl, W. R. (2017). Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs, 31(4), 317-334.
10. Nimesh, S., Aggarwal A., Kumar, P., Singh, Y., Gupta, K., Chandra, R. (2006). Influence of acyl chain length on transfection mediated by acylated PEI nanoparticles. Int J Pharm. 7;337(1-2), 265-74.
11. Sawant, R. R., Sriraman, S. K., Navarro, G., Biswas, S., Dalvi, R. A., & Torchilin, V. P. (2012). Polyethyleneimine-lipid conjugate-based pH-sensitive micellar carrier for gene delivery. Biomaterials, 33(15), 3942-3951.
12. Sun, W., Zheng, W., & Simeonov, A. (2017). Drug discovery and development for rare genetic disorders. American Journal of Medical Genetics Part A, 173(9), 2307-2322.
13. Zakeri, A., Kouhbanani, M. A. J., Beheshtkhoo, N., Beigi, V., Mousavi, S. M., Hashemi, S. A. R., ... & Movahedpour, A. (2018). Polyethylenimine-based nanocarriers in co-delivery of drug and gene: a developing horizon. Nano reviews & experiments, 9(1), 1488497.