
 发布时间:2025/11/13 点击数:210
发布时间:2025/11/13 点击数:210 用于血管疾病建模的芯片:一种通用且可扩展的解决方案

一、引言
血管异常(Vascular anomalies, VAs)是血管生成过程中,出现的缺陷,目前的治疗方法存在明显局限性,包括病灶部位难以接近以及不完全切除后的再生长。因此,亟需创立更为微创的医学治疗方案。为了开发新的治疗手段,体外模型十分重要,它们可用于初步评估潜在治疗方法的有效性和毒性。这类体外模型需要精que且生理相关的培养条件,并依赖复杂的三维(3D)细胞实验。
本研究旨在开发一种多功能的器官芯片,用于模拟在不同流体动力学、力学生物学和生物学条件下,正常血管与血管异常之间的功能差异与失调机制。
二、方法

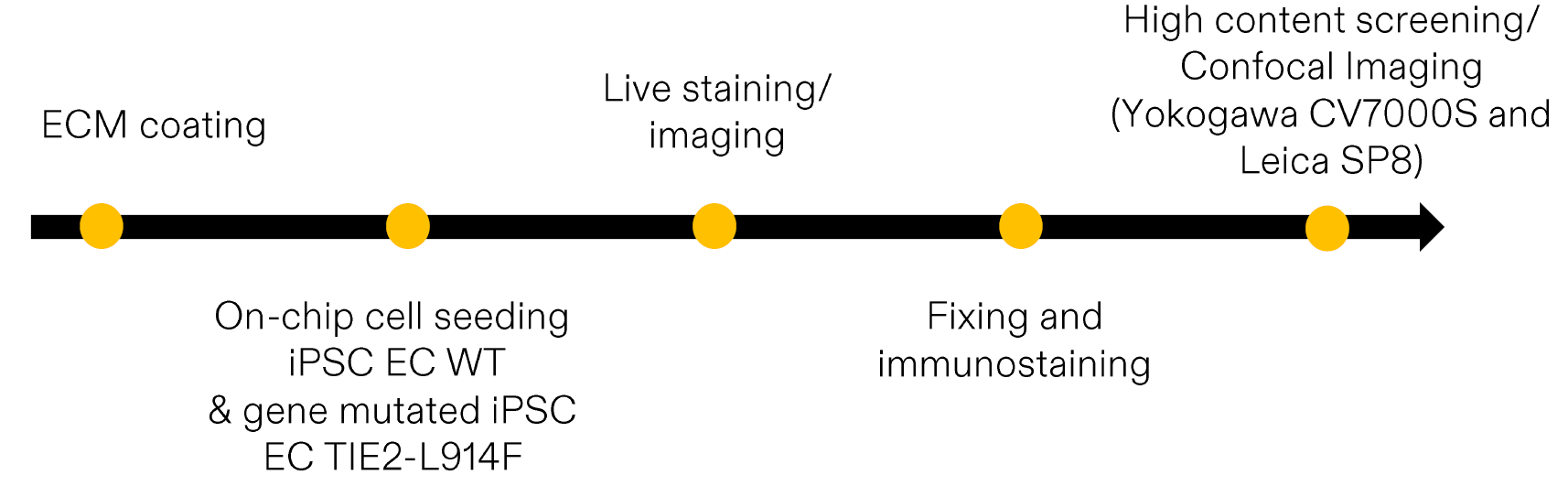
1、在流体作用下,评估野生型(WT)iPSC来源的内皮细胞(iPSC ECs)与携带血管畸形致病突变 TIE2 L914F 的 iPSC ECs 之间的形态学差异。
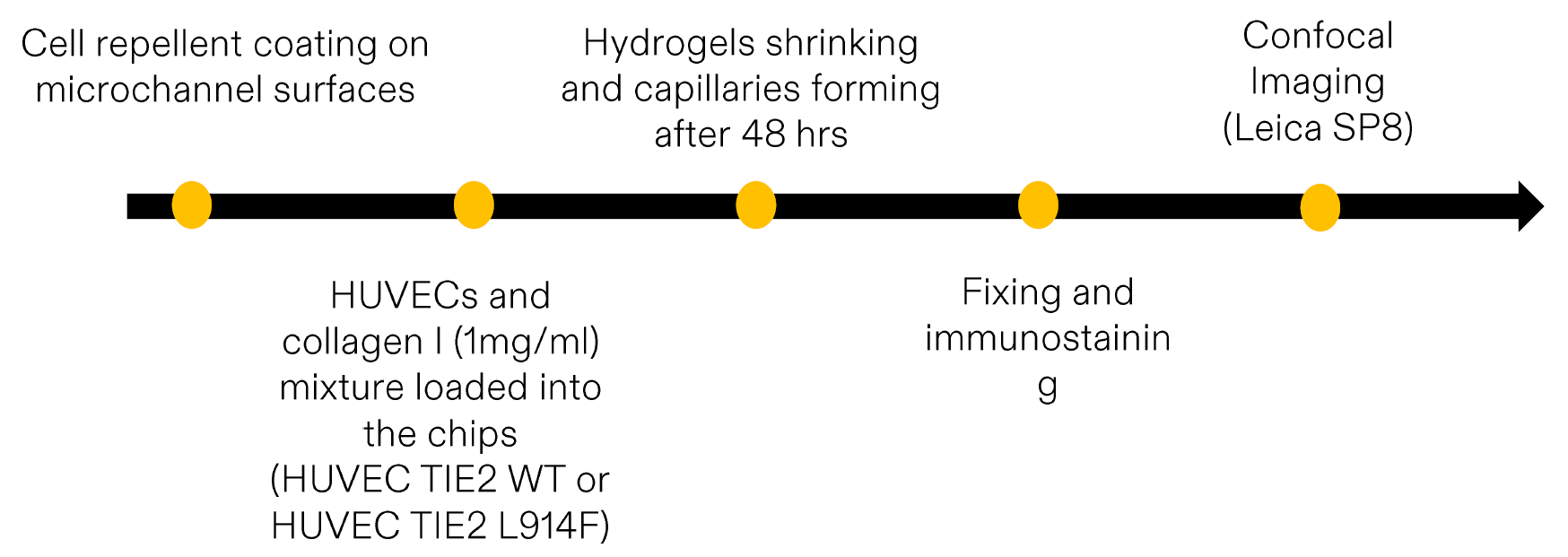
2、在芯片上利用 I 型胶原水凝胶(collagen-I hydrogels) 自组装形成单根毛细血管结构。
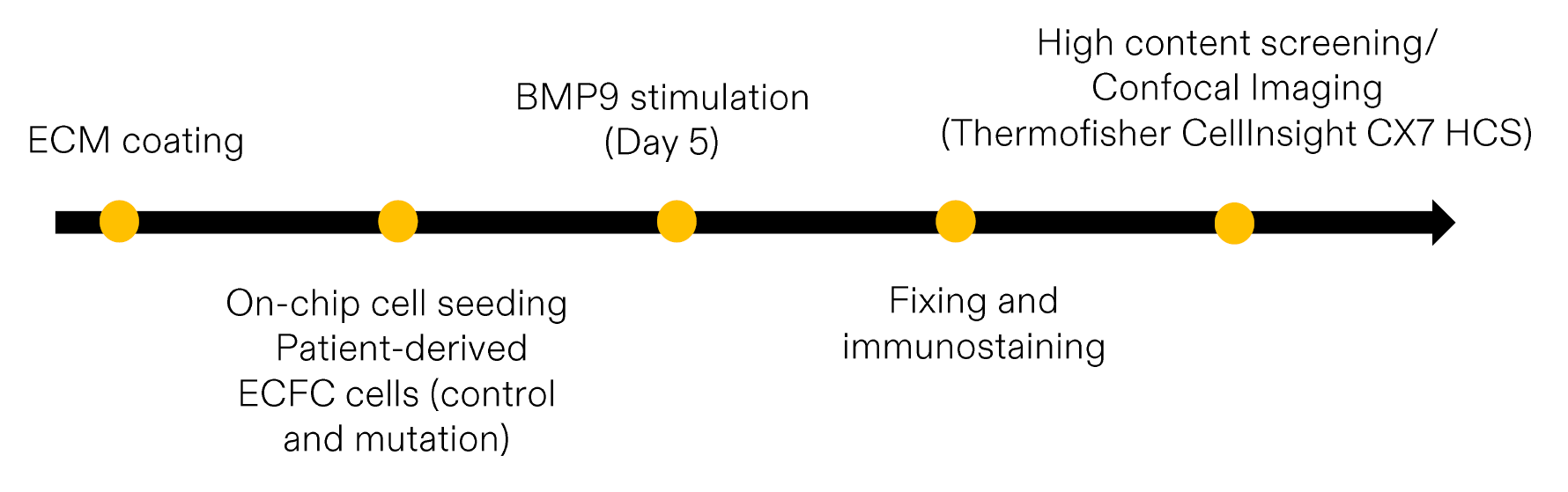
3、在流体作用下,评估两株对照组(CTL)和两株携带 ALK1 突变 的患者来源内皮集落形成细胞(ECFCs) 对 BMP9 的 p-Smad1/5 信号响应情况。
4、利用重力驱动的流体形成符合生理相关性的剪切应力梯度


符合 ANSI / SLAS 标准尺寸
可同时进行 24 个实验,并可扩展至 96 个实验
无泵式流体控制系统

可形成可灌流的管腔结构
可调控的仿生表面刚度
剪切应力梯度
三、结果
1、液流与受限的微流控结构会影响正常与静脉畸形 iPSC 来源内皮细胞(iPSC ECs)的形态与排列方式。
在芯片上的细胞培养与传统二维培养在细胞形态和排列上存在明显差异。受限的微流控通道有助于细胞沿着流体方向排列,而二维培养中的细胞则随机分布。在静态芯片上,由于缺乏流体作用,携带 TIE2 突变 的细胞表现出更为细长的形态,细胞间连接不够完整,导致 肌动蛋白(actin)与细胞核(nuclei)取向分布更广,并且细胞核的伸长程度受到影响。

2、在芯片上利用 I 型胶原水凝胶(collagen-I hydrogels) 实现自组装形成单根毛细血管。
在 I 型胶原水凝胶的辅助下,细胞能够在芯片内部形成自由支撑的毛细血管结构。这种方法能够在无需缩小微通道尺寸的情况下,获得一致且微小的毛细血管结构。在该模型中,携带 TIE2 突变 的细胞在流体方向上的细长度降低,同时表现出更少且更短的肌动蛋白纤维(actin filaments)。细胞间连接的排列方向为 +90°,从而形成更清晰、更锐利的细胞边界。

3、在流体作用下,评估对照组与携带 ALK1 突变 的 内皮集落形成细胞(ECFCs) 对 BMP9 的 p-Smad1/5 信号响应
图像采集通过 Thermo Fisher 的 CX7 高内涵分析显微镜完成。我们在微通道的薄段(高剪切应力)与厚段(低剪切应力)均获得了良好的 p-Smad1/5 染色信号。结果显示,与对照组 ECFCs 相比,ALK1 突变供体 4 的 p-Smad1/5 染色强度略低。


总体来看,在 BMP9 刺激的细胞中,p-Smad1/5 水平在高剪切应力的薄段中更强,这与文献报道(Baeyens 等,2016,《J Cell Biol》)一致。这些结果令人鼓舞,但仍需进一步验证。未来的重要方向是建立芯片模型,以研究 HHT(遗传性出血性毛细血管扩张症)相关突变如何影响 p-Smad1/5 对流体刺激的响应机制。
四、结论
我们建立了一种微流控方案,可结合多种细胞系与机械及生物刺激,用于 体外模拟多种血管异常(VAs),从而使我们能够研究病变血管细胞的功能变化。
未来的研究将利用这一已建立的方案和模型,深入探究血管异常的分子机制,并评估不同的候选治疗药物,以期纠正细胞异常并改善血管畸形病灶。
借助这一标准化且具转化意义的方案,我们旨在提供一种优于动物实验的替代方案,更重要的是,加速针对罕见疾病的治疗研究与新药发现进程。
总部设在芬兰,奥卢的器官芯片制造商AKITA,by Finnfadvance,成立于2019年。系统搭载拥有高通量器官芯片板,该板可被设计成单器官和多器官,兼容多种成像模式,高人体相关性的下一代人体体外模型,加速药物开发,降低临床前试验失败的风险,也可用于个性化医疗。
上海曼博生物医药科技有限公司是AKITA官方授权的中国经销商。关注我们,敬请期待AKITA的更多血管及器官芯片应用,欢迎咨询曼博生物获取本文的原文海报资料。


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













