基于器官芯片培养各种组织/器官的应用
器官芯片目前主要有两个大的潜在方向:药物研发和个体化治疗。其中,药物研发领域会是器官芯片应用的第一轮,该领域还包括化学物质、食品、化妆品的研发。器官芯片的应用贯穿药物开发全流程,包括但不限于疾病建模、安全性毒理学、ADME /药理学。
我们将分别从肿瘤(类器官)芯片、肝脏芯片、肠道芯片、肺芯片、血脑屏障芯片、神经芯片、皮肤芯片和其他器官芯片展开介绍,如果您对类器官感兴趣,可 点击查看类器官 相关内容。您也可以 点击此处 从“下载中心”获取我们的《类器官芯片整体解决方案彩页》
一、肿瘤(类器官)芯片(PDTOs-on-chip)
肿瘤通常由高度异质的细胞群组成,这导致其对化疗的反应存在差异。使用传统的2D培养肿瘤细胞系往往不能正确反映药物在体内的耐药情况。有研究者(下图)使用基于微流控的高通量器官芯片板(品牌AKITA)来培养 患者来源的肿瘤类器官 (Patient-Derived Tumor Organoids,PDTOs),在液流的不断灌注下,肿瘤组织显示出比2D静态培养条件下对化疗药物更顽强的抵抗能力,甚至可以在液流中加入免疫细胞来检测治疗效果。
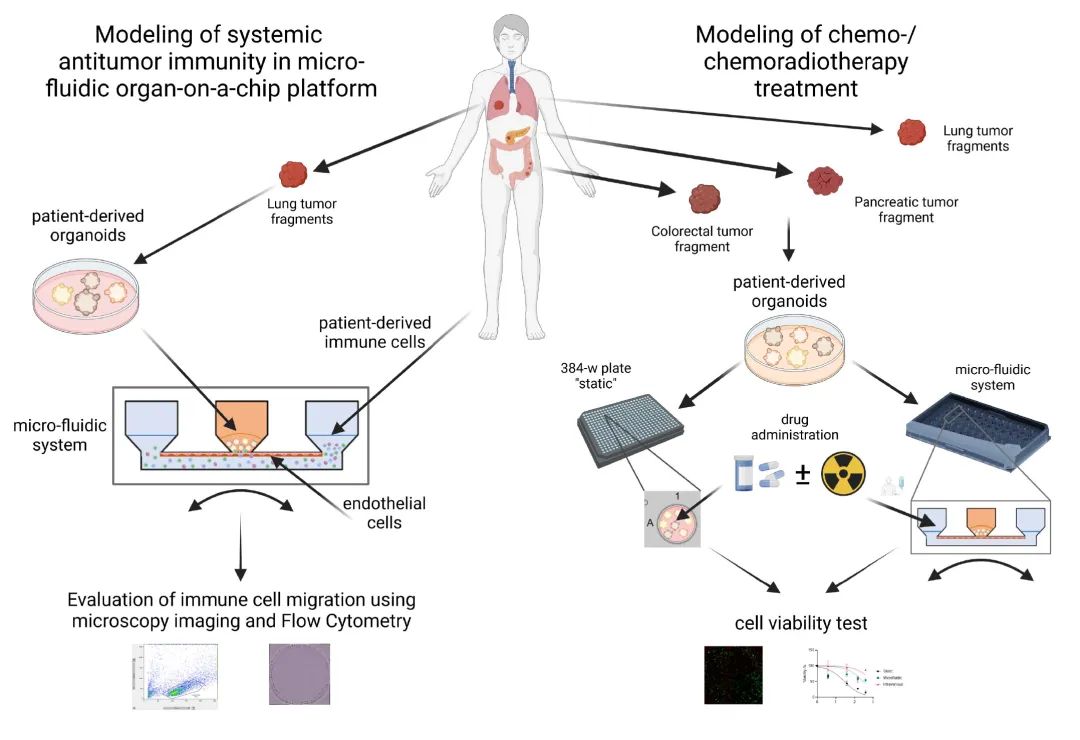
图:AKITA用于测试静脉注射药物和免疫细胞输送的肿瘤芯片模型
除了小分子药物外,器官芯片也可以兼容免疫疗法、腺病毒、溶瘤腺病毒等 新治疗模式 (下图),这是传统的2D静态培养所达不到的效果。
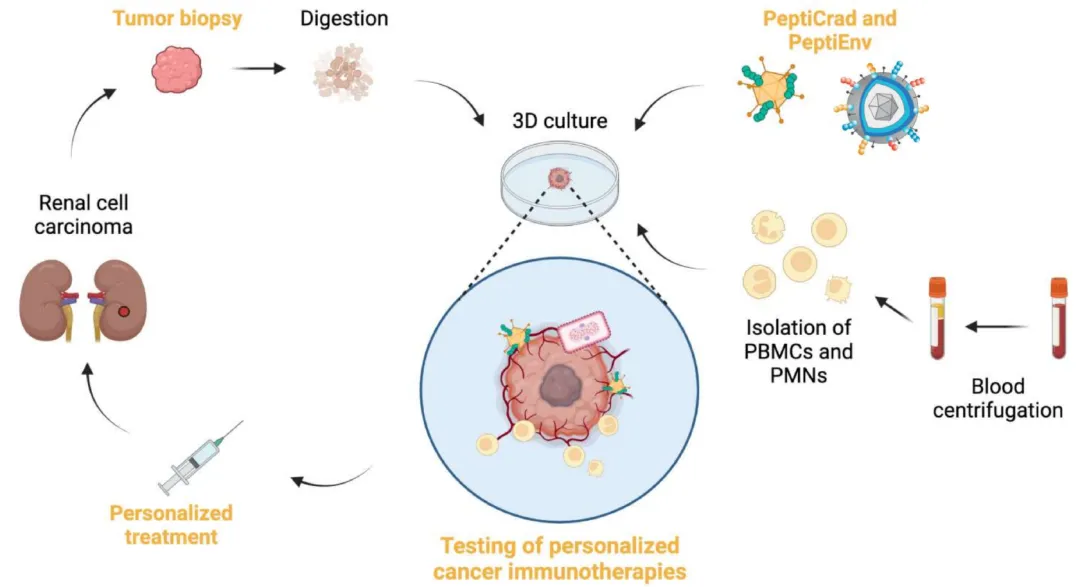
图:基于微流体器官芯片3D培养的肿瘤免疫疗法或腺病毒、溶瘤腺病毒模式图
建立能够再现患者肿瘤和免疫系统的改进型临床前人类模型,将为测试患者特异性反应、开发个性化治疗方案铺平道路,并加速其进入临床的进程。
二、肝脏芯片(Liver-on-chip)
肝脏一直是药物开发关注的重点,而基于微流控器官芯片所构建的体外肝模型相较于传统静态培养原代肝细胞,则展现出更好的生理相关性。
应用一:毒性研究
肝脏是最易受药物毒性和药物性肝损伤(DILI)影响的器官之一。DILI是药物消耗的主要原因,已知超过750种FDA批准的药物具有一定程度的DILI风险,当前技术的局限性主要有:体外到体内翻译效果不佳;未能对毒性原因提供深入的机制见解;许多先进的体外模型的通量较低,限制了数据点的数量;进行慢性暴露试验具有挑战性;不可能产生有毒的 I 期和 II 期代谢物等,此外,由于遗传或免疫反应差异,细胞系/动物模型不太适合测试新的人类特异性模式。
器官芯片能够灌注下以 3D 形式培养的人类原代肝实质细胞和非实质细胞(NPC),以形成组织,从中可以检测功能性肝脏特异性终点,这项技术可以利用临床生物标志物报告将实验室数据翻译、转化为临床数据,评估多个细胞终点以确定毒性机制,生成每个3D组织中多种化合物的完整剂量反应曲线,长期肝培养可促进数周的重复给药,将毒性 I 期和 II 期代谢物的产生与细胞健康测量关联起来。

扫描上方二维码观看肝构建模式视频
该项技术被称为器官芯片(OOC)或微生理系统(MPS),代表性供应商之一是英国的 CN Bio ,旗下的PhysioMimix被 FDA深度评价 ,在药物开发的监管机构认可度层面非常权威。
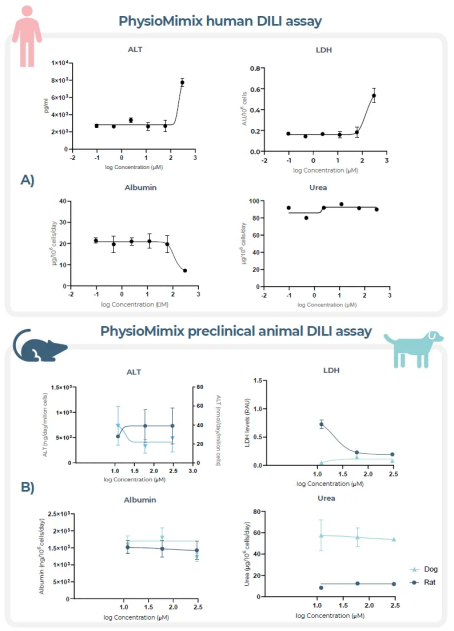
图:人类DILI OOC/MPS模型检测西他生坦sitaxentan的毒性数据与临床一致,而动物模型并未检测出DILI
另外,来自Charles River的研究团队将CN-Bio的肝脏芯片(Liver-on-Chip,LOC)技术应用于 遗传毒性 测试产生了更有预测性的人体结果,潜在地有助于弥补体外和体内研究之间的差距(下图)。

图:用于遗传毒性测试的芯片肝脏(LOC)模型概述
应用二:疾病研究
非酒精性脂肪肝病 (NAFLD) 是全世界导致慢性肝脏疾病的最常见的原因之一。在西方,它影响了约20-30%的成年人。大约有20%的被诊断为NAFLD的人继续发展为 非酒精性脂肪性肝炎(NASH) , 伴随着脂肪变性、炎症、肝脏中免疫细胞的出现和胰岛素抵抗相关。目前的临床前模型无法复制人类 NASH,这是导致药物流失的一个因素。
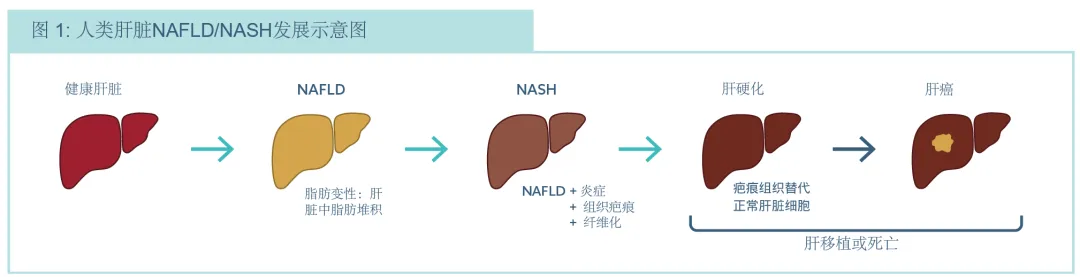
图:人类肝脏NAFLD/NASH发展示意图
器官芯片 NASH 模型 ,使用三种人肝主要细胞,在高脂培养基的持续14天的灌注下(下图),其全转录谱,相比于小鼠模型,与人类样本匹配度更高,对NASH治疗药物作用效果的测试,从可溶性炎症和纤维化生物标志物定量、免疫荧光染色和共聚焦成像等方面,结果也更加准确。目前,已经有NASH器官芯片的数据支持药企(Inipharm的INI-822用于代谢性肝病治疗)经过FDA的检验 ,通过IND申报,目前正在进行临床测试。
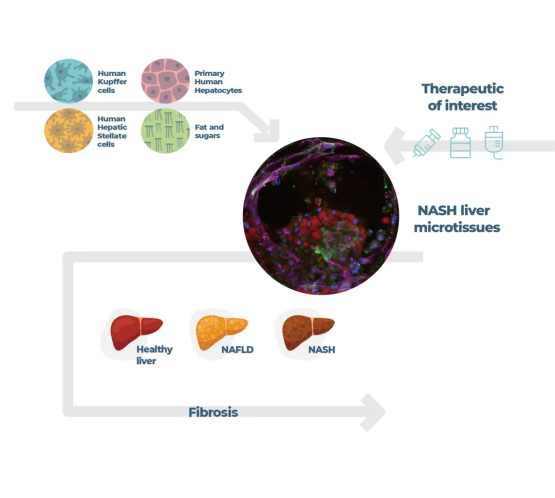
图:使用肝芯片模型产生类似NASH的表型
乙型肝炎病毒(HBV)感染与肝硬化和肝癌的发展密切相关,但目前能治愈乙肝的药物很少,主要是在药物研发过程中,由于缺乏合适的体外模型来概括肝细胞中病毒生命周期的所有步骤,以及难以为HBV复制建立生理上完整的宿主细胞模型。肝细胞是 HBV 的靶细胞,由于肝脏是一个复杂的 3D 结构,即使有原代肝细胞(PHH)作为疾病模型静态培养,但它们也会在培养过程中快速去分化(形态改变、CYP450酶活性丧失等)。
器官芯片能构建剖析HBV的全生命周期,包括患者源HBV的复制和HBV的cccDNA,可以维持肝功能至少40天。研究发现,感染HBV后的先天免疫和细胞因子反应与在HBV感染患者中观察到的反应相似,因此可以分离对免疫逃避和生物标志物验证重要的途径。
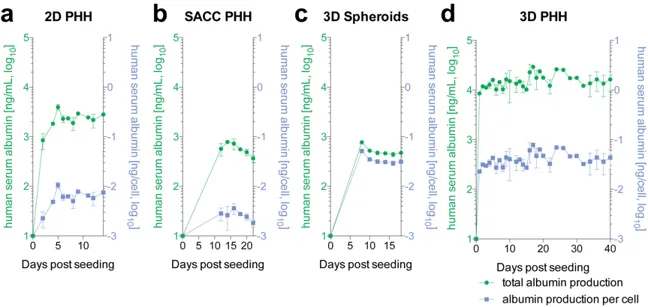
图:不同肝细胞培养模型的纵向白蛋白分泌
应用三:ADME药理学
吸收(Absorption)、分布(Distribution)、代谢(Metabolism)和排泄(Excretion),即ADME是指示药物给药后行为的四个关键过程,在表征化合物的药代动力学(PK)性质和生物利用度方面起关键作用。口服生物利用度是指药物在通过肠壁吸收和肝脏首过代谢后到达全身循环的比例。ADME和生物利用度在确定化合物的安全性和毒理学特征方面至关重要,因此是药物开发前临床阶段的重要测量指标。
在一项对184种化合物的开创性研究中,发现动物模型与人类生物利用度的相关性较弱(R² = 0.34),而简单的肠道(如Caco-2细胞系)或肝脏(如肝微粒体和悬浮肝细胞)模型要么无法解释肝脏代谢,要么无法顾及肠道吸收。

扫描上方二维码观看肝-肠/肺构建模式视频
器官芯片能使多个器官(如肠-肝、肺-肝)通过液流连接在一起,以模拟药物吸收和首过代谢等过程 (下图)。
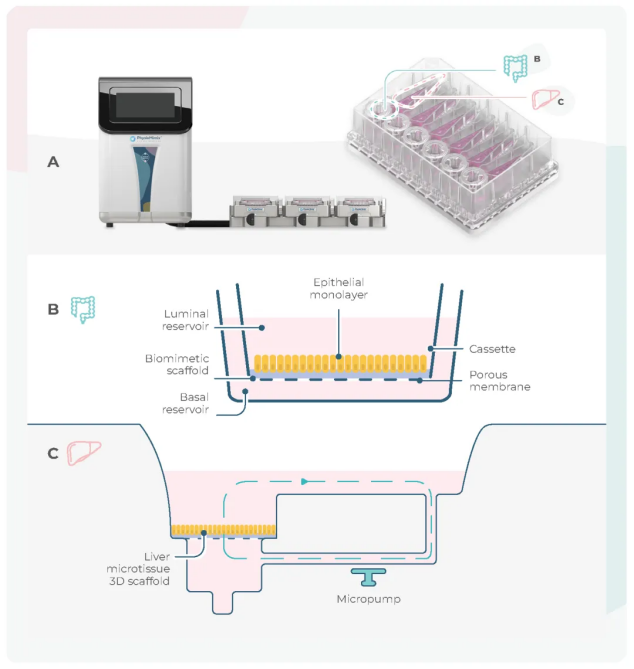
图:在双器官芯片中,肠-肝的设置
已有的数据表明,多器官组成的器官芯片,其人体药物生物利用度数据的相关性会高于其他模型(下图),在这一块的应用,罗氏 最近的发表的研究非常有说服力。
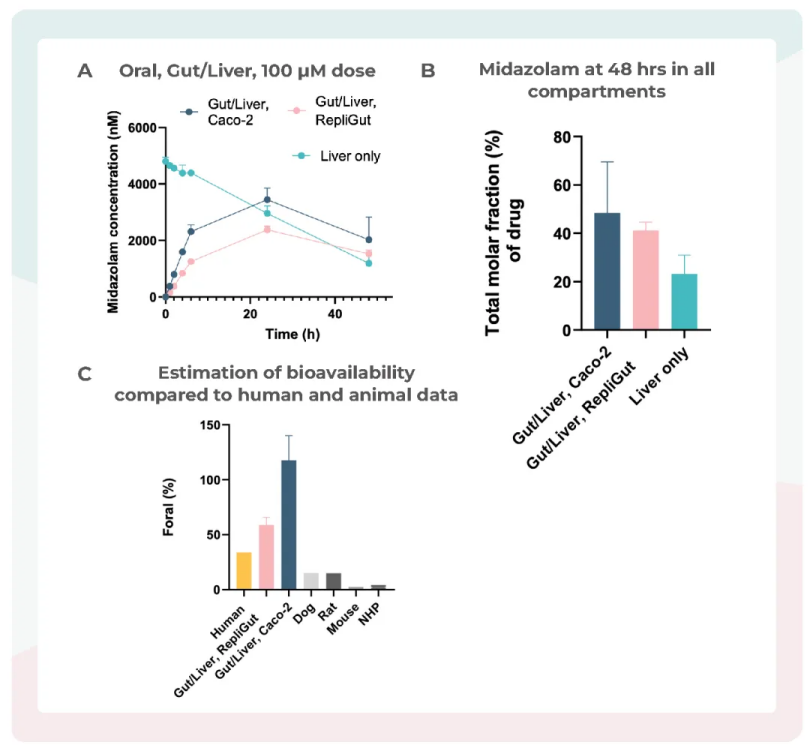
图:肠-肝器官芯片改善咪达唑仑(Midazolam)人类生物利用度的相关性
三、肠芯片的应用(Gut-on-chip)
应用一:人体药物渗透性研究
Caco-2细胞(人类结肠腺癌)单层培养是一个公认的行业标准的体外模型,用于预测药物通过肠屏障的渗透性。但也存在公认的局限性。与人类小肠(50-100Ω/ cm2)相比,Caco-2模型的跨上皮电阻(TEER)值通常高出一个数量级(1400-2000Ω/ cm2)。此外,Caco-2模型未能再现小肠的细胞多样性,仅表现为上皮成分。
近年来,人们一直在努力改进临床前药物开发和疾病研究中使用的体外模型,尤其是器官芯片(OOC)的使用也越来越多。通过灌注细胞培养基来模拟组织中的血流,在3D支架中培养细胞和/或使用多种细胞类型来更好地反映细胞多样性来实现的。通过利用MPS创建更多转化相关模型,有机会改进用于预测药物渗透性的体外肠道模型。

扫描上方二维码观看肠构建模式视频
使用Caco-2/HT29两种肠细胞,在 英国CN Bio旗下的PhysioMimix器官芯片中构建肠芯片 ,通过TEER评估发现,器官芯片的数据非常贴近真实的人体,而且与静态Caco-2培养物相比,肠道MPS提高了药物渗透性的预测能力(下图)。

图:通过定量LC-MS测定肠道MPS和Caco-2静态培养物中各药物的Papp,并与人体生物利用度进行比较
另外,在肠芯片构建方面,多数供应商通量低、且需要事先加入涂层,而来自芬兰的器官芯片 供应商AKTIA 的技术,每块芯片可以提供32-128个样品,同时AKITA还和Bio-Spun合作开发了可生物降解的(PDLGA-PLLA双层)的 3D电纺纳米纤维膜 ,提高了使用的便利性,节省了时间,并避免了涂层引起的变异性。
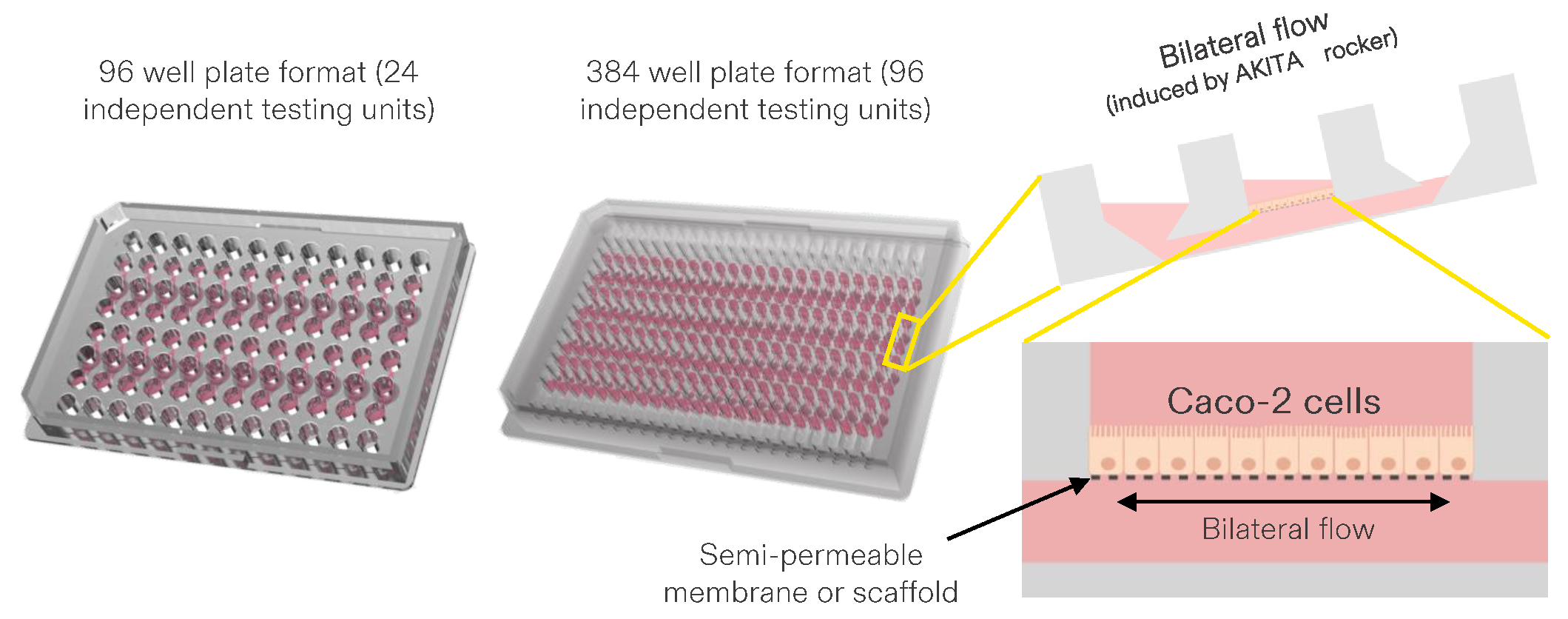
图:AKITA微流控板构建肠模型的设计
使用 西班牙供应商Beonchip 的BE-Doubleflow构建肠道模型更加灵活,其液流控制系统既可以兼容注射泵、蠕动泵、也可以搭配摇摆系统,对于处于早起研发的用户非常友好。联系我们,查询您的控制器是否兼容我们的芯片,也可联系我们帮您选购质量好的国产设备。
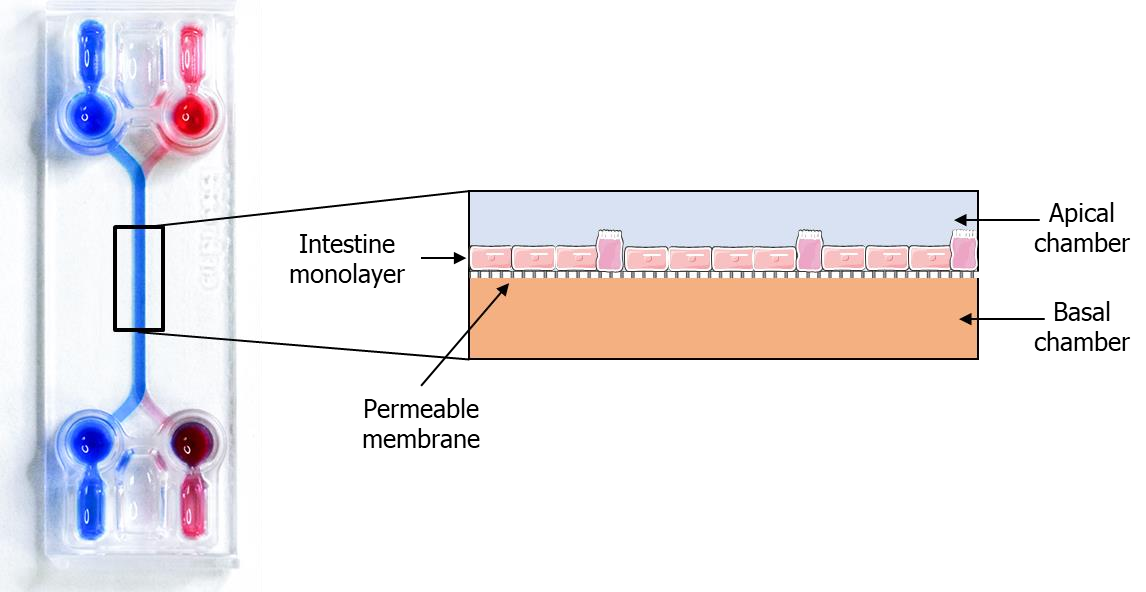
图:使用BE-Doubleflow构建的肠道模型
四、肺芯片的应用(Lung-on-chip)
探索与肺相关的疾病,如肺炎、急性肺损伤、慢性阻塞性肺疾病(COPD),以及评估对肺部的污染和预防性治疗的发展。
肺是最容易受到感染和损伤的内部器官,因为它不断暴露于环境中的吸入颗粒和病原体。与此相对应,呼吸系统疾病是导致死亡和残疾的主要原因之一。
呼吸系统疾病在全球十大主要死因中占据三席,包括慢性阻塞性肺病(COPD)(第3位)、下呼吸道感染(第4位)和肺癌(第6位)。然而,新治疗方法进入市场的可能性只有3%,而其他疾病治疗方法的这一比例为6-14%。这种需求与治疗产出之间的差距部分可以用缺乏能准确预测药物反应的、与人类相关的临床前模型来解释。

扫描上方二维码观看肺构建模式视频
CN Bio的PhysioMimix 器官芯片(OOC)系列微生理系统(MPS)被FDA充分评估,代表了一种新颖但已被证明成功的体外肺模型系统:通过结合灌流、原代细胞共培养和气液界面(ALI)实现这一目标(下图)。
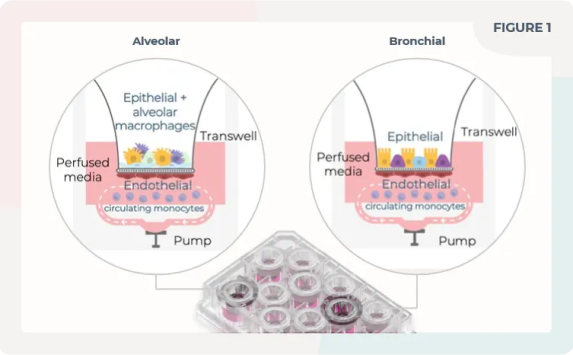
图:使用CN Bio构建的肺泡芯片和支气管芯片
另外,在肺芯片构建方面,多数供应商通量低,而来自 芬兰的器官芯片供应商AKTIA 的技术,每块芯片可以 提供32-128个样品的通量 ,通量的增加意味着成本、时间的减少。
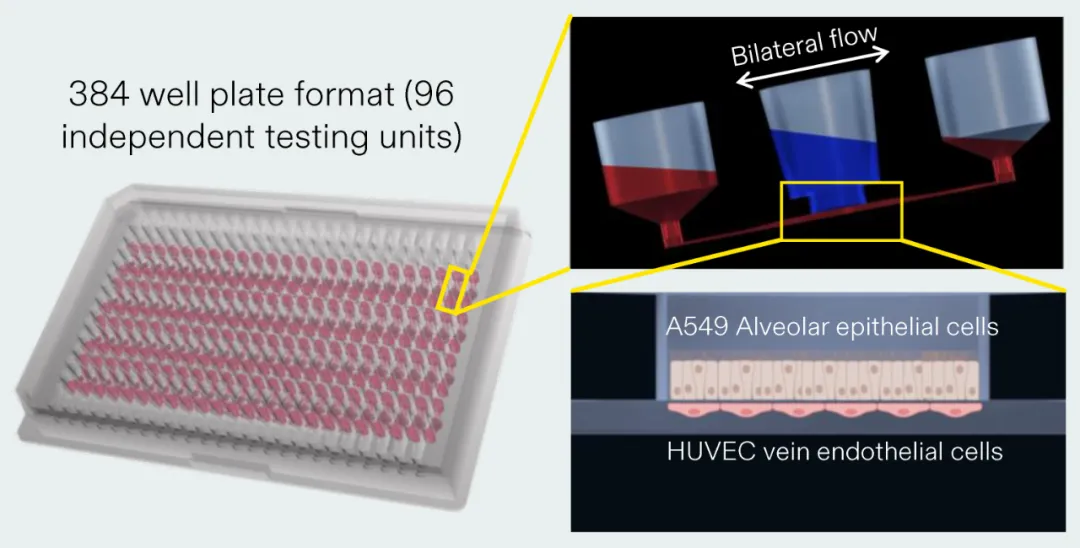
图:使用AKITA plate构建的Lung-on-a-chip
使用 西班牙供应商Beonchip 的BE-Doubleflow构建肺模型更加灵活,其液流控制系统既可以兼容注射泵、蠕动泵、也可以搭配摇摆系统,对于处于早起研发的用户非常友好。联系我们,查询您的控制器是否兼容我们的芯片,也可联系我们帮您选购质量好的国产设备。
另外,由于使用了抗渗透性效果非常好的医用级环烯烃聚合物 (COP) 和环烯烃共聚物 (COC) ,氧气和水蒸气的透过率非常低,可以通过控制培养基中的浓度和通量来精确控制微通道内的这些气体,通过仔细控制这些参数,可以在Beonchip的芯片内进行缺氧实验。
五、血脑屏障芯片(BBB-on-chip)
应用一:神经药物渗透性测试
血脑屏障(Blood-brain barrier,BBB)调节物质进入中枢神经系统。它在大脑稳态中起着关键作用,但也可能阻断药物/化合物的进入,从而抑制其治疗效果。由于模型的复杂性,在体外构建静态培养的单层血脑屏障,其渗透性往往较人体更大,因此检测的结果有很大的误差。
来自芬兰的 器官芯片供应商AKTIA 凭借其技术,能够使得 血脑屏障 处于动态的液流灌注下,使得结果更加准确(下图)
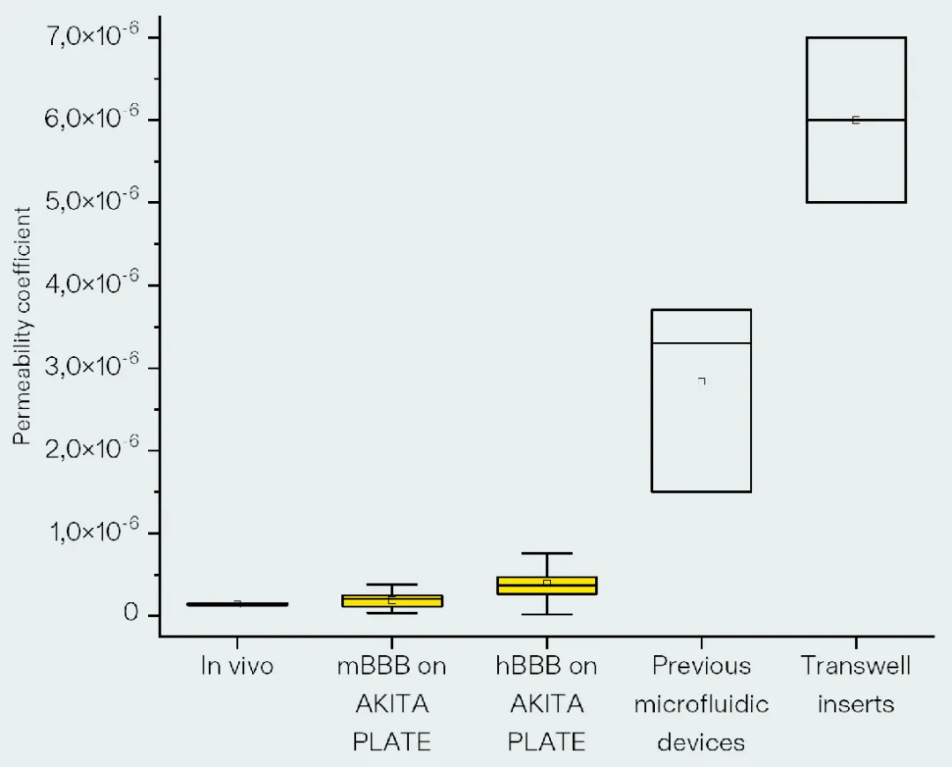
图:各方法构建的BBB-Chip渗透性测试,基于AKITA的技术更接近人体内结果
另外,标准的96孔板和384孔板格式芯片,其通量也更高(每块芯片可以提供32-128个样品),更快的得到相应的实验结果(下图)。

图:使用AKITA plate构建的 BBB-on-a-chip
使用 西班牙供应商Beonchip 的BE-Gradient构建血脑屏障模型更加灵活(下图),其液流控制系统既可以兼容注射泵、蠕动泵、也可以搭配摇摆系统,对于处于早起研发的用户非常友好。联系我们,查询您的控制器是否兼容我们的芯片,也可联系我们帮您选购质量好的国产设备。

图:使用BE-Gradient构建的BBB-on-a-chip
应用二:神经(脑)类器官及神经炎症测试
干细胞技术的进步使得生成具有组织学、分子和生理特性的人类化三维 (3D) 模型成为可能,有研究者使用 芬兰的AKTIA芯片技术 ,生成了 3D的血脑屏障+脑类器官模型 (下图),用于测试来自间充质干细胞的细胞外囊泡治疗神经炎症的潜力,该模型更高通量且具功能性,而且从多维度(ELISA、免疫荧光共聚焦显微镜图像、qRT-PCR定量分析等)正确反映神经芯片正确反映促炎因子和外泌体EV处理后的抗神经炎症效果。
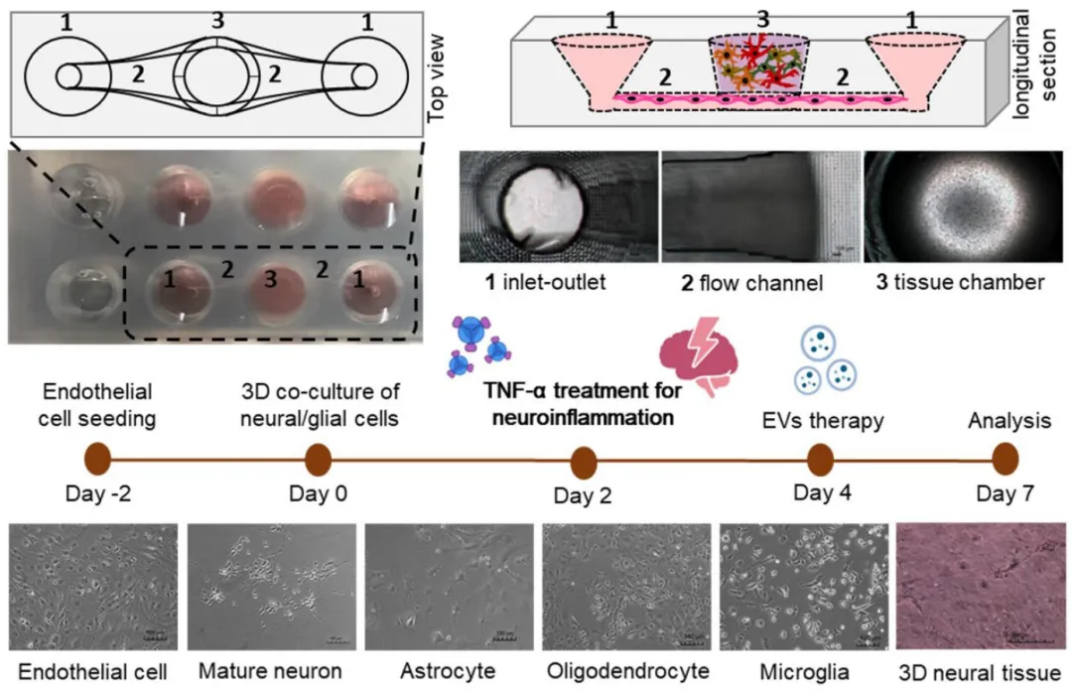
图:神经芯片的示意图
六、神经芯片
使用神经元作为天然生物传感器来支配任何器官,使用高通量电生理记录筛查急性或慢性反应,使用人工智能预测临床结果。
应用一:疼痛模型
疼痛模型包括以下四个领域:①周围神经系统(PNS)疾病:神经-PNS相互作用,如神经损伤、化疗引起的周围神经病变(CIPN);②神经炎症:模型相关的神经免疫作用,如炎症性肠病(IBD);③神经系统疾病:神经-中枢神经系统相互作用,如阿尔兹海默病;④肿瘤学:模型相关的神经肿瘤相互作用,如化疗引起的周围神经病变(CIPN)、儿童胶质母细胞瘤。
PNS模型芯片:周围神经由运动神经和感觉神经组成,这两种神经元类型具有截然不同的特性,尽管它们彼此相连,但各自有着特定的功能。
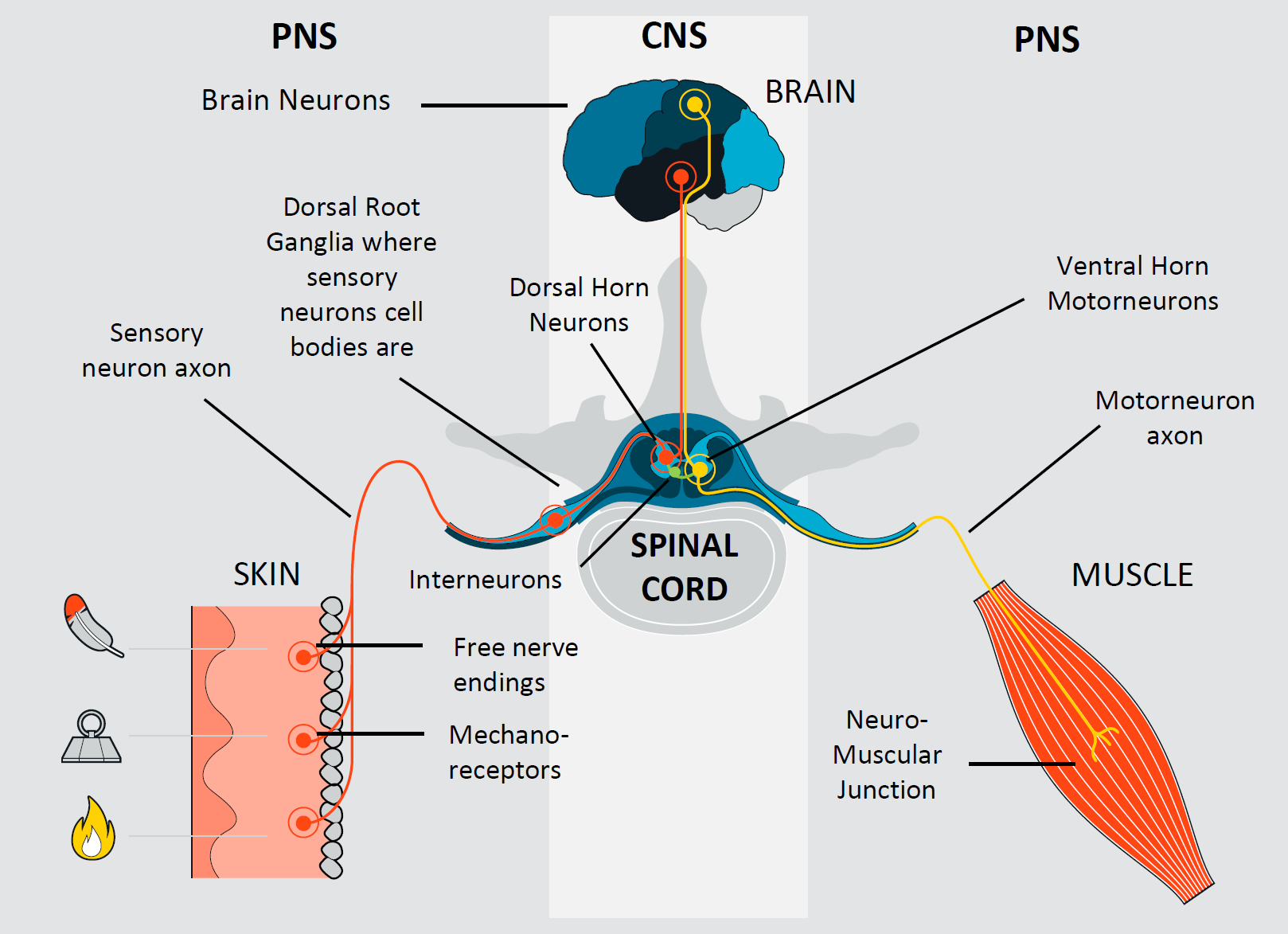
PNS模型芯片(源图请联系我们获取)
器官芯片(Organ-on-Chip, OoC) 的优势在于能够将神经元的胞体(soma)与其轴突(axon)分离,从而重现人类的解剖结构,并使损伤或治疗方案更贴近真实生活场景。为了区分和分别研究每种细胞类型,法国器官芯片供应商 NETRI (点击查看)在 OoC 平台上优化了运动神经元和感觉神经元的培养方法,使用感觉神经元(ax0555,AxolBioscience)和运动神经元(01279,FCDI)成功开发了一个创伤性疼痛模型(神经损伤模型)以及一个化疗引起的周围神经病变模型(CIPN 模型)(下图,原文可联系曼博)。
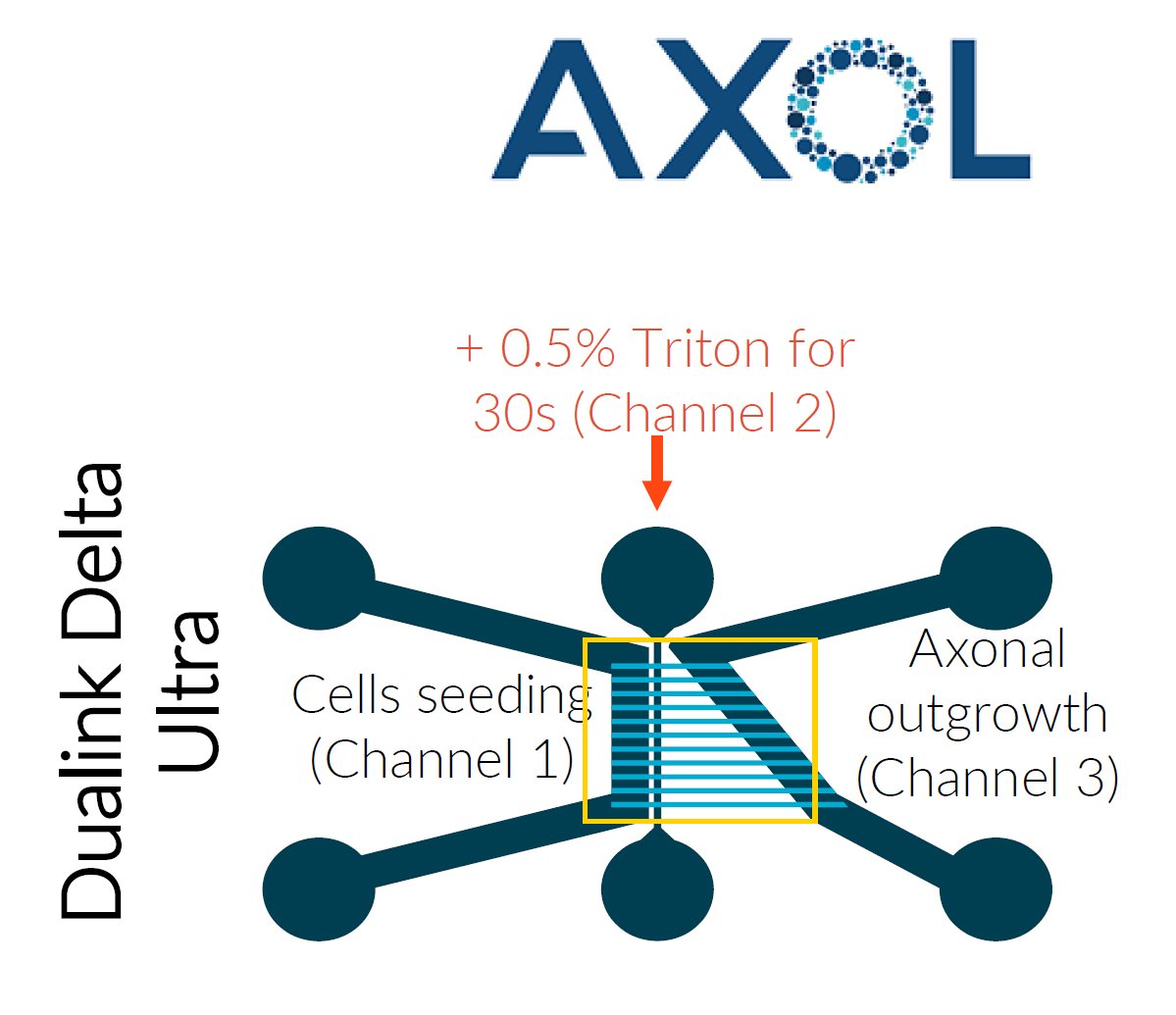
模式图:在NETRI的DuaLink Delta Ultra芯片中培养的人iPSCs衍生神经元。(源图请联系我们获取)
阿尔兹海默病:在过去十年中,没有任何在临床试验中测试过的可以减缓或治愈神经退行性疾病的分子被推向市场。开发新的 AD 疗法确实是一项真正的挑战,失败率高,开发时间长。许多因素导致了临床试验的全球失败,法国器官芯片供应商 NETRI (点击查看)开发阿尔茨海默病创新器官芯片 (OoC) 模型的first step已经迈出(下图),神经流体设备有助于阐明该疾病的潜在机制并寻找有效的新疗法。
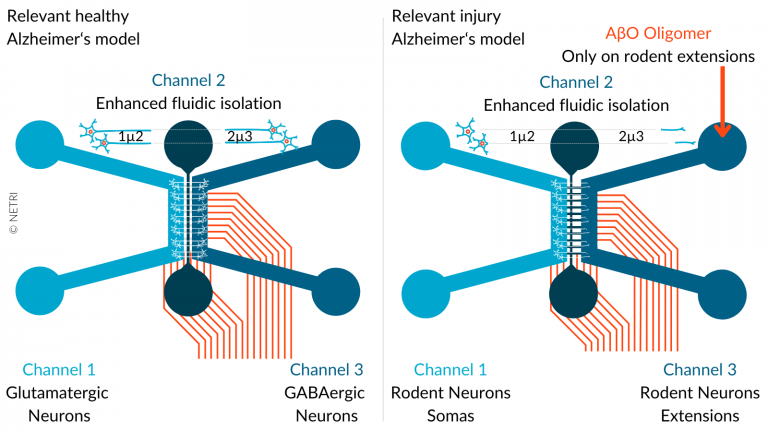
阿尔茨海默病创新器官芯片 (OoC) 模型图
• DuaLink MEA或DuaLink Shift MEA神经流体芯片和CNS 神经流体培养物
• 将 hiPSC 衍生的谷氨酸能神经元(通道 1)和 GABA 能神经元(通道 3)进行分区共培养,以创建病理参考模型
• 在通道 3 中添加 ETAP-Lab 的淀粉样蛋白 β1-42 (AβO) 寡聚体,以创建改变的病理模型
应用二:神经-皮肤轴
皮肤是一种保护性器官,能够感知多种触觉、温度或有害刺激,属于瞬时受体电位(TRP)家族的一些感受器,例如TRPV1,可以引发辣椒素诱导的热痛或组胺诱导的瘙痒感。在某些情况下,由于环境因素的影响,神经末梢可能会被过度激活,导致敏感性皮肤综合征(SSS)。因此,对于化妆品和制药行业来说,开发SSS治疗方案时,选择相关性强且具有预测性的体外模型很重要。
近年来在iPSC(诱导多能干细胞)操作方面的进步是推动全人类体外模型开发的关键因素。法国器官芯片供应商NETRI(点击查看)开发了一种基于iPSC的微流控装置和器官芯片模型(见下图,具体可联系曼博生物获取原文),神经支配皮肤芯片在药物或化妆品开发的不同阶段具有多重优势。该模型预计通过减少样本量和试验周期来降低研发成本,同时避免了动物实验的相关费用。总体而言,这些预测性的临床前模型旨在更好地筛选新药候选物,从而降低临床研究(I期和II期)失败的风险。
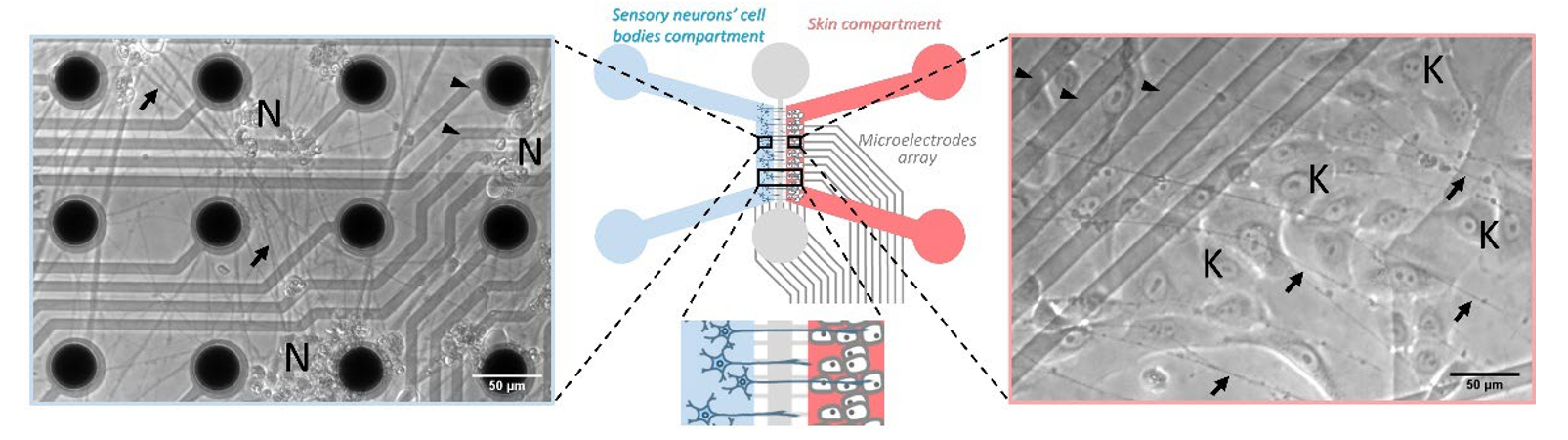
图:神经-皮肤芯片。中央展示了微流控装置的结构设计,下方为三个隔室的放大视图。左侧为人类iPSC分化的感觉神经元(N)在隔室化培养中的典型透射光图像。右侧为人类原代角质形成细胞(K)在隔室化培养中的典型透射光图像,神经突(箭头所示)从一个通道生长到另一个通道。培养在微电极阵列(箭头头所示)上完成,可对神经元活动进行电生理记录。
应用三:神经-肠轴
炎症性肠病(IBD)是一类复杂的慢性炎症性胃肠道疾病。最近的证据表明,肠-脑轴在胃肠道和神经系统疾病,尤其是IBD中可能具有关键作用。在此,法国器官芯片供应商NETRI(点击查看) 提出了一个微流控技术的概念验证模型(下图,原文联系曼博生物获取),该微流控装置结合了微电极阵列(MEAs),实现了(i) 在微流控装置中实现人类神经元细胞与免疫细胞的共培养;(ii) 提供一种非侵入性分析方法,研究在炎症环境中两种细胞类型之间的通信,以模拟IBD炎症条件下的神经-免疫相互作用。
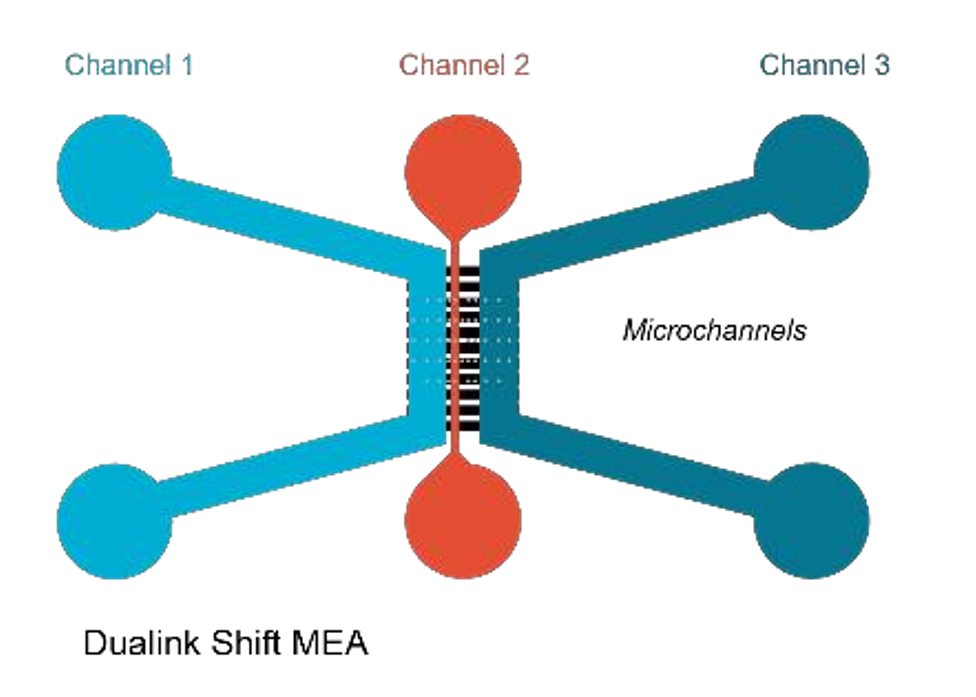
图:芯片由三个隔室组成,隔室之间由微通道分隔。每个通道由于微通道的架构而在液体上相互隔离,同时允许神经突和轴突伸入其中。Channel 1和Channel 3是人类谷氨酸能神经元培养的位置。Channel 2是一个不对称的通道,通过微通道将胞体和神经突隔离,形成体外突触通信。
数据表明,当胞体暴露于活化的树突状细胞时,通过突触连接的谷氨酸能神经元两个隔室之间会以自下而上的方式传递电生理信号。该模型研究证实了在炎症条件(如IBD)下树突状细胞与神经元之间的通信。这一器官芯片系统为与肠道成分结合的复杂模型奠定了基础,从而开发用于通过阻断黏膜水平的肠-脑轴进行药物化合物筛选的装置,并可能为患者提供帮助。
七、皮肤芯片
皮肤器官芯片(Skin-on-Chip)技术在近年来迅速发展,因其能够在体外模拟人类皮肤的多层结构和生理功能,具有大量的应用及重要的科学和临床意义。皮肤器官芯片可以用在药物(或化妆品)测试与毒性评价、伤口愈合与再生研究、皮肤病研究、个性化医疗与美容产品测试、免疫反应与过敏性反应测试。
来自芬兰的 器官芯片供应商AKTIA 凭借其技术,能够使得皮肤组织处于模拟人体血流的动态液流灌注下(下图),生理相关性更高,测试的结果更加准确,较高的通量(每块芯片可以提供32-128个样品)能够在减少动物实验的同时,提高药物开发的效率,推动皮肤护理与再生医学的创新。
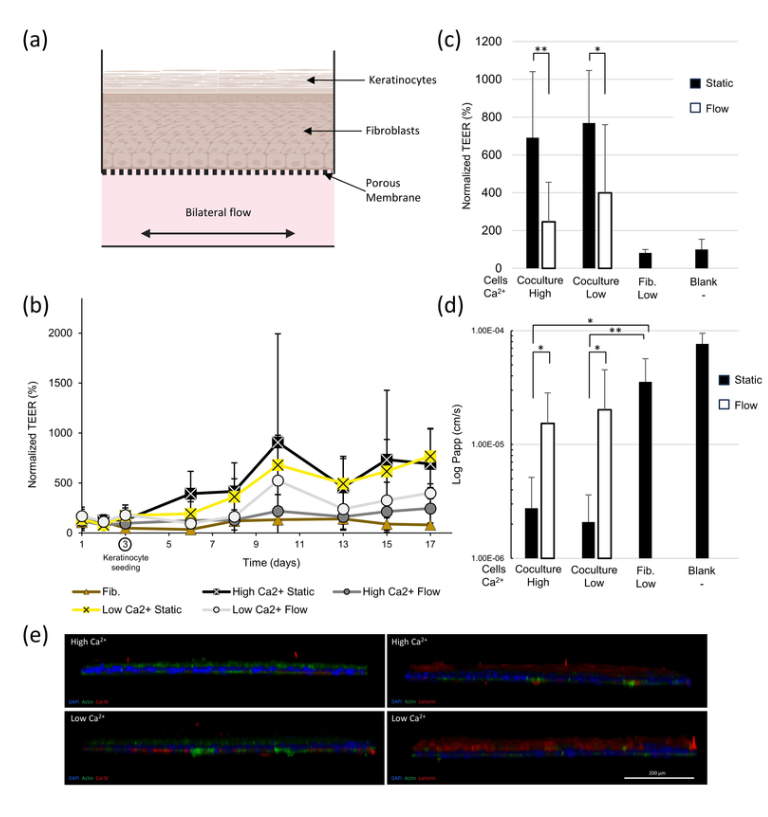
图:在AKITA芯片板上的皮肤模型
八、其他器官芯片的应用
人体内不同器官对于血液的需求量不同,对应到体外模型的器官芯片则是不同的器官对应的液流速度不同。英国器官芯片供应商CN Bio 在2018年发表了一篇文章,以展示其多种器官科学、可靠的构建过程(下图)。其中涉及到多达十种器官的构建过程及建议,包括肝、胰腺、肠、肺、心、肌肉、脑、内皮、肾、皮肤。
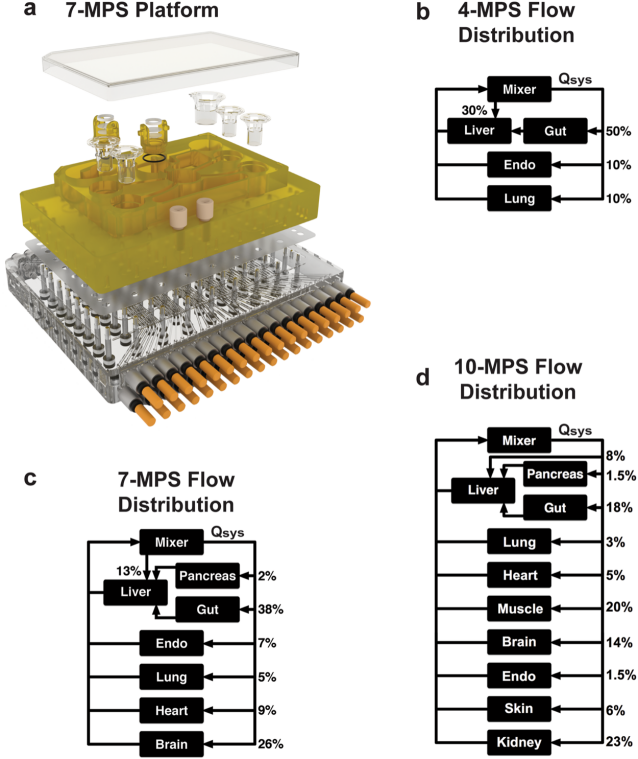
图:CN-Bio MPS系统4器官、7器官、10器官的分流、分区分解图
(图片来源于:SCIENTIfIC REPOrTS | (2018) 8:4530 | DOI:10.1038/s41598-018-22749-0)
如果您有任何器官芯片构建、应用、技术相关的疑问,请联系我们,也欢迎您关注“曼博生物”微信公众号,获取 器官芯片的整体解决方案 的资源。
相关产品