
 发布时间:2025/11/05 点击数:439
发布时间:2025/11/05 点击数:439 构建更好的血管芯片:Biolaminin 521能增强剪切应力下huVEC的粘附性
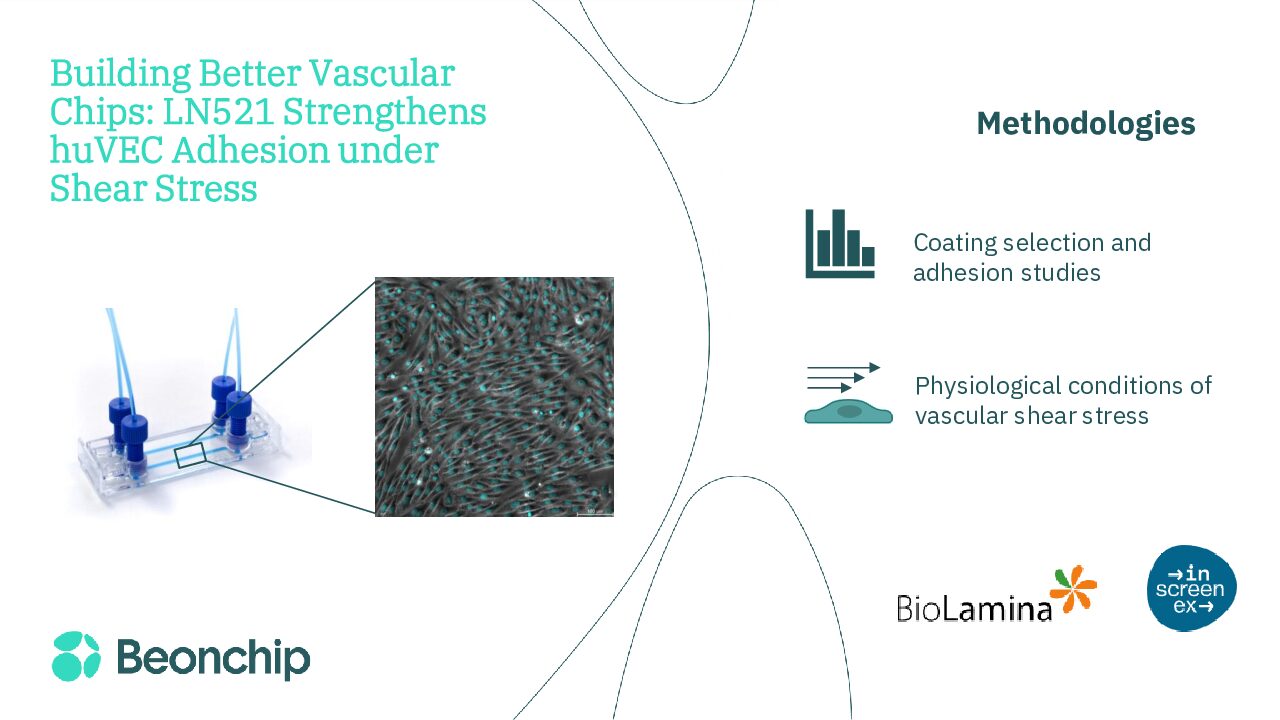
一、摘要
在体外重现血管微环境,不仅需要动态培养系统(如微流控器官芯片装置),还需要合适的细胞外基质(ECM)涂层。层粘连蛋白(Laminin)是基底膜的重要组成部分,能够提供特定的生化信号,调控内皮细胞的黏附、形态及功能。
本研究比较了 Laminin-521(LN521)、Laminin-411(LN411)和明胶(gelatin)三种涂层在静态和流体剪切力条件下对人脐静脉内皮细胞(huVEC)培养的影响。结果显示,LN521在静态与动态培养条件下均能明显促进细胞黏附、铺展与稳定性,是构建内皮微流控模型的合适基质。研究结果强调了 ECM 选择在建立生理相关性强的体外血管系统中的重要性,为药物测试、组织工程以及减少动物实验提供了新的思路。
二、引言
在体外重现内皮细胞的生理微环境很重要但颇具挑战。虽然静态培养系统(如在涂层基底上的培养)可提供一定信息,但无法模拟内皮细胞在体内所经历的血流动力学作用,如剪切力、脉动流及压力变化等(1,2)。相较之下,动态培养系统,尤其是基于微流控器官芯片技术的模型,能够模拟这些生物力学信号,从而更真实地再现血管生态位的生理特征(3)。
然而,建立合适的培养条件与选择合适的系统同样重要。决定内皮模型成功与可重复性的因素包括:细胞接种密度、培养时间、流速类型与强度、以及基底成分(4)。其中,细胞外基质(ECM)涂层尤为关键,它不仅提供结构支撑,还通过生化信号调控细胞的黏附、生存与分化(5)。
三、如何选择合适的ECM涂层?
ECM涂层的选择应考虑细胞类型及其来源的组织或器官。层粘连蛋白(Laminin)是一类多结构域的糖蛋白,是大多数组织基底膜的关键组成部分。不同器官和血管床具有特定的 Laminin 亚型组合,这些组合为细胞黏附、极性和信号传导提供特异性因子。值得注意的是,只有完整的 Laminin 分子才能提供完整的受体与生长因子结合域,从而实现共信号机制,重建真实的微环境(6,7)。此外,使用无动物源的Laminin涂层可减少批次差异,提高研究结果的可转化性,相比之下,明胶等未定义涂层则存在较大变异性。
本研究系统评估了不同 ECM 涂层在暴露于剪切力的微流控装置中对内皮细胞培养的适用性。具体而言,我们比较了 Laminin-521(LN521)、Laminin-411(LN411)与常被商业供应商推荐作为标准涂层的明胶。
Laminin-521 guangfan存在于血管基底膜及相关生态位中,能够促进内皮单层的稳定黏附、铺展与成熟(8)。相比之下,Laminin-411 主要分布于血管及淋巴管基底膜,在细胞迁移、芽生与血管生成过程中发挥关键作用(9)。
四、方法
1、静态培养下的涂层选择
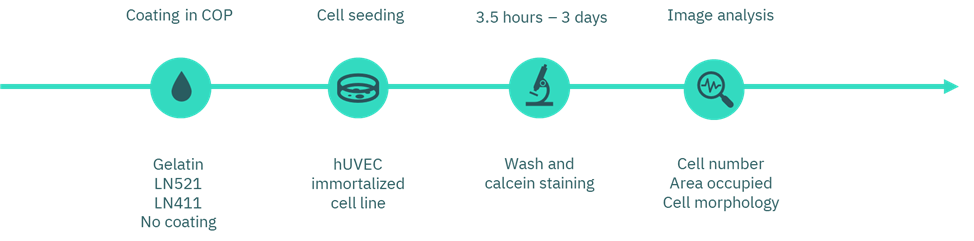
图1. 涂层选择的实验流程图。
首先,我们制备了不同的涂层,包括明胶(gelatin, Inscreenex, INS-SU-1015-50)、Laminin-521(LN521, BioLamina, LN521-02)、Laminin-411(LN411, BioLamina, LN411-02),并设置未涂层孔作为对照。实验使用了基于环烯烃聚合物(COP)的商业化 96 孔板。
明胶涂层按厂家推荐浓度 0.5% 配制;同时,Laminin 涂层按 10 µg/mL 的浓度制备。每个涂层溶液在 4 °C 下过夜孵育。次日,小心移除溶液,在细胞接种前不进行清洗。
随后,我们将人脐静脉内皮细胞(huVEC;CI-huVEC, INS-CI-1002)以每孔 2000 个细胞的密度接种于培养基(INS-ME-1011)中。孵育 3.5 小时及 3 天后,分别用 PBS 轻轻清洗孔,并用 Calcein 染料标记活细胞以进行荧光显影。最后,通过显微成像评估细胞形态和数量,并使用 Fiji (ImageJ) 软件进行定量分析。
2、流体条件下的培养
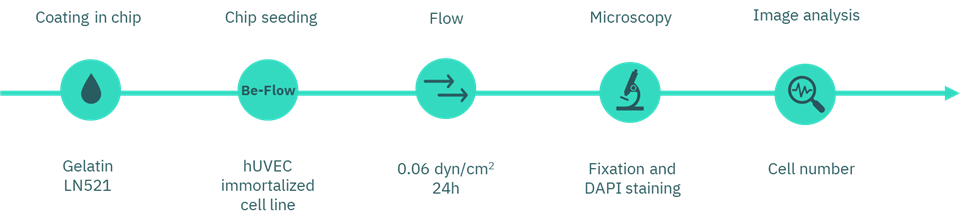
图2. 流体实验(Flow Assay)的工作流程图。
我们选择了Be-Flow微流控装置进行实验,该系统专为血管模型和血管模拟而优化。该装置兼容多种细胞类型与 ECM 涂层,其优良的光学特性允许在高倍及油镜条件下获得高分辨率成像。标准芯片配置包含两个独立的矩形通道(高度 270 µm,宽度 1.5 mm),见图 3。
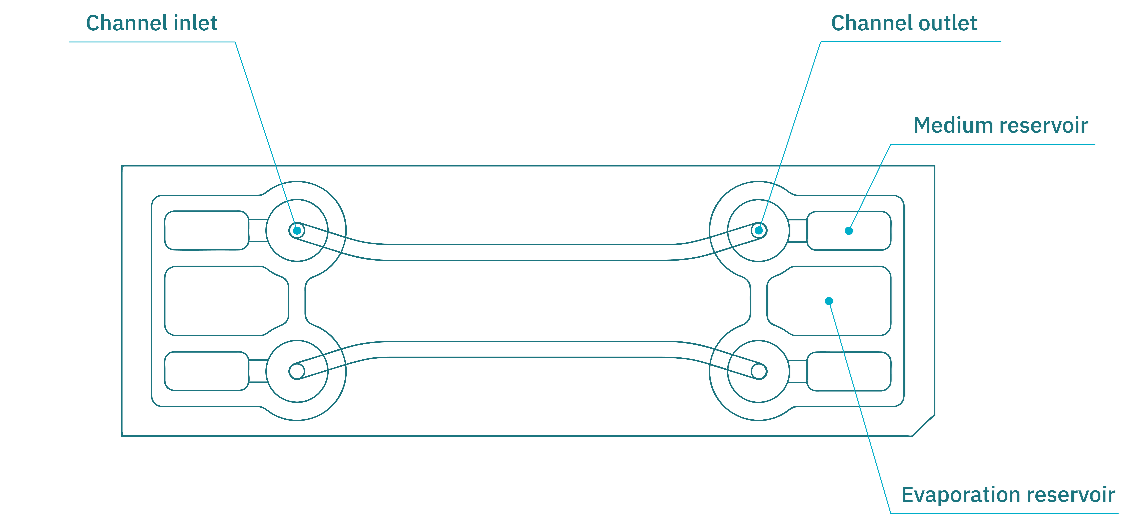
图3. Be-Flow 器官芯片的示意图。每个芯片包含两个独立的通道,可用于静态培养或灌流培养。图中标注的部分对应培养基储液池、进/出口以及通道的观察区域。
在使用前,装置在培养箱中预温孵育过夜。每个芯片包含两种涂层条件:一个通道涂覆明胶,另一个通道涂覆 Laminin-521(浓度与前述涂层选择部分相同)。
在涂层步骤中,我们向每个通道注入 30 µL 涂层溶液,并在 37 °C 下孵育 2 小时。孵育结束后,小心吸除涂层溶液,不进行清洗。随后,将 100,000 个 huVEC 以 每通道 30 µL 的体积接种。细胞黏附 2 小时后,向每个通道加入培养基(400 µL/通道;每个储液池 200 µL)以填充储液区。最后,将装置置于摇动条件下过夜孵育,以促进培养基的均匀交换。(此处可联系我们获取Be-Flow的标准操作指南)
3、灌流培养
次日,我们使用 柔性管路套件(Flexible Tubing Kit for Syringe Flow) 将芯片连接至灌流系统(见图 4)。实验中使用一个20mL注射器(套件中未包含)以提供培养基流动。注射泵设定为施加0.6 dyn/cm²的剪切应力,持续灌流24小时。
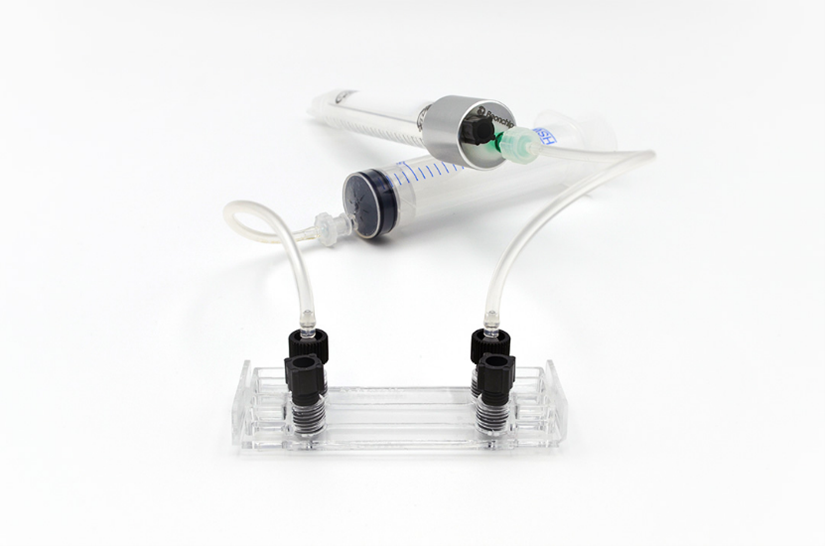
图4. Be-Flow 通道连接至灌流系统的示意图,包括柔性管路、注射器及多系统连接盖(multi-system CAP)。
4、固定与染色
实验结束后,我们按照固定步骤使用4%多聚甲醛(PFA) 对细胞进行固定。随后使用 DAPI 对细胞核进行染色,并在通道表面沿视野范围对细胞数量进行定量分析。

表1:参考摘要。上海曼博生物是Beonchip和BioLamina正式授权的中国代理商。
五、结果
1、短期与中期的内皮细胞黏附
本研究的首要目标是确定哪种 ECM 蛋白能为内皮细胞提供更适合的短期与中期黏附基底。为此,我们在接种后3.5小时定量分析了不同ECM涂层表面上黏附的细胞数量。在这一早期阶段,处于良好锚定条件下的细胞会迅速与基底建立初步接触。
结果显示,在明胶(gelatin)、Laminin-411(LN411)及未涂层对照组中,黏附细胞数量相近(图 5B),约为1400–1600个。而在 Laminin-521(LN521)涂层表面上,细胞黏附数量明显更高,超过2000个。经过 3 天培养后,这一差异进一步扩大(图 6B):LN521 表面仍有约 1500 个细胞存留,而明胶为 <900 个,LN411 为 <700 个,对照组则不足300个。
2、细胞形态
除黏附数量外,我们还通过细胞形态参数 圆度(circularity = 4π × [area/perimeter²]) 评估形态变化(图 5C 与图 6C)。圆度值为 1.0 表示wanmei的圆形,而趋近于 0.0 的值则表示细胞形态更为细长或多边形。
在胰蛋白酶消化并从培养瓶中脱离后,悬浮状态下的细胞呈球形,圆度接近 1.0。接种后,细胞在基底上黏附、铺展并逐渐变扁平,根据细胞类型与基质相互作用的不同,其形态趋向细长或多边形,从而导致圆度下降。
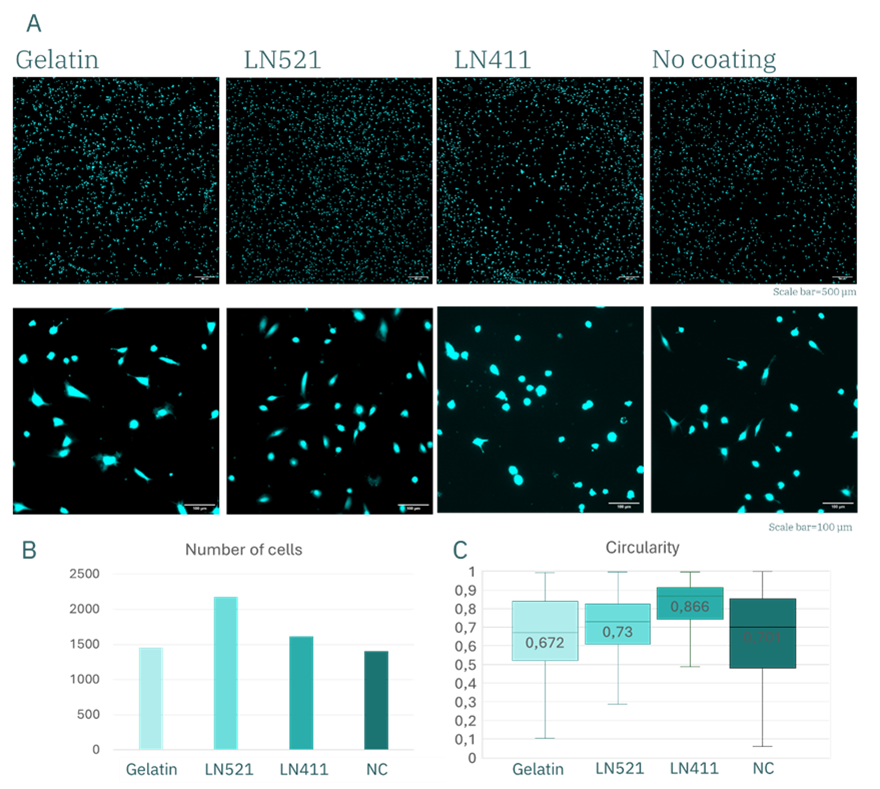
图5. huVECs 培养3.5小时后的表现。(A) Calcein 染色的 huVECs 荧光显微图像;(B) 细胞数量的定量分析图;(C) 细胞形态参数分析图。
在培养 3.5 小时后,明胶、LN521 与对照组的圆度值相近(约为 0.7),而 LN411 的圆度略高。
然而,到第 3 天时,这些差异xianzhu放大:明胶和 LN521 组的圆度下降至约 0.4,而 LN411 仍维持在约 0.7。
这表明,在明胶和 LN521 基底上培养的细胞呈现出更为细长的梭形形态,反映了良好的黏附与铺展状态;而在 LN411 上的细胞则保持圆形,提示其黏附能力较差,细胞健康状况受损。
结合细胞数量保持较好的结果,这些发现共同表明:在本实验条件下,LN521 是huVEC培养的更优涂层。
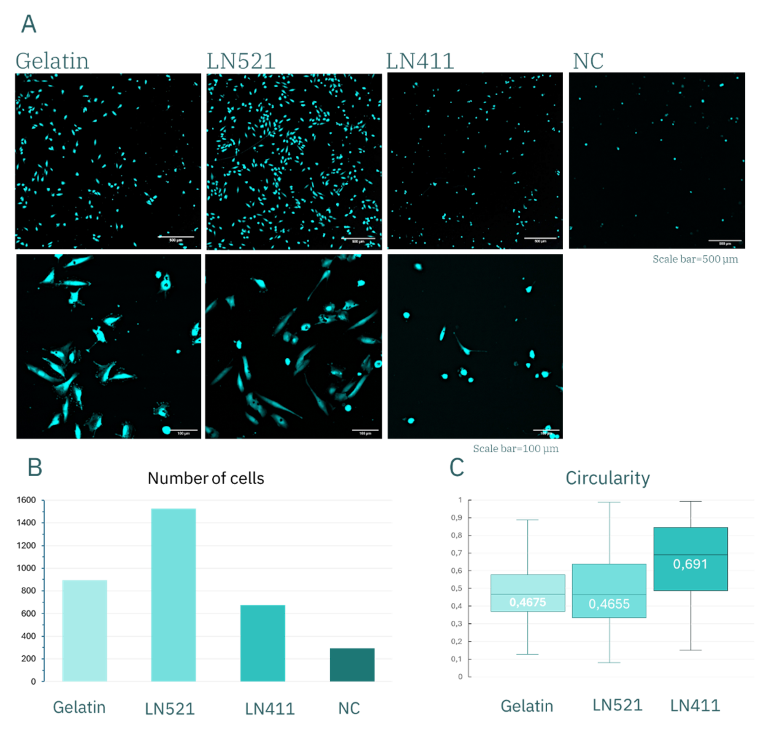
图6. huVEC 培养 3 天后的表现。(A) Calcein 染色的 huVEC 荧光显微图像;(B) 细胞数量的定量分析图;(C) 细胞形态参数分析图。
3、明胶与LN521在剪切应力下的表现
基于上述结果,我们选择明胶和 LN521 作为 Be-Flow 微流控装置流体实验的涂层条件。
如图 7 所示,在施加 0.06 dyn/cm² 剪切应力灌流 24 小时后,明胶涂层通道内的内皮单层出现破坏,而 LN521 涂层仍保持完整、汇合的单层结构。在剪切应力作用下,明胶组的细胞脱落数量约为 LN521 组的两倍。

图7. Be-Flow 装置中 huVEC 的流体实验。(A) 带螺纹接口连接柔性管路的 Be-Flow 微流控装置示意图;(B) 在明胶涂层上,灌流培养基(0.06 dyn/cm²)后的内皮细胞荧光图像代表;(C) 在 Laminin-521 涂层上,灌流后的内皮细胞荧光图像代表;(D) 两种涂层条件下每个视野的细胞数量定量分析。
六、结论
综合来看,这些结果表明 Laminin-521(LN521) 不仅在静态条件下为 huVEC 提供了更佳的黏附性与细胞形态,还能在微流控剪切应力下保持更高的稳定性和抗脱落能力。
通过将微流控动态培养与精心选择的 Laminin 亚型相结合,体外内皮模型能够更准确地再现血管生物学的复杂性,从而推动基础研究和转化应用的发展,包括药物测试、血管组织工程以及减少动物实验。
如需进一步信息,请联系上海曼博生物,我们的团队将提供必要的技术支持与指导。
关于Beonchip S.L.
总部位于西班牙,由Rosa Monge(机械工程博士),Ignacio Ochoa(生物学博士)和Luis Fernández(微技术博士)于2016年在萨拉戈萨大学成立,工程师和生物学家的合作是设计人性化和容易使用的微流控器官芯片的关键。
Beonchip 提供多种一次性微流控芯片,大量已发表的文章、操作视频、SOPs支持微技术在体外重建人体更相关的生理环境,其产品易于操作,即使对于没有微流控操作经验的研究人员也不例外。
上海曼博生物医药科技有限公司是Beonchip S.L.授权的中国代理商,如果您想构建肿瘤、免疫、内皮/上皮屏障、气液界面(ALI)、血管等体外模型,可联系我们或经我们授权的经销商。
![]()
参考文献
1.Huh D, Matthews BD, Mammoto A, Montoya-Zavala M, Hsin HY, Ingber DE. Microengineered physiological biomimicry: Organs-on-chips. Lab Chip. 2011;11(22):3341–7.
2.Bhatia SN, Ingber DE. Microfluidic organs-on-chips. Nat Biotechnol. 2014;32(8):760–72.
3.Song JW, Munn LL. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 2011;108(37):15342–7.
4.Aird WC. Phenotypic heterogeneity of the endothelium: I. Structure, function, and mechanisms. Circ Res. 2007;100(2):158–73.
5.Kleinman HK, Martin GR. Matrigel: Basement membrane matrix with biological activity. Semin Cancer Biol. 2005;15(5):378–86.
6.Yousif LF, Di Russo J, Sorokin L. Laminins in vascular development and disease. Matrix Biol. 2013;32(5):303–11.
7.Domogatskaya A, Rodin S, Tryggvason K. Functional diversity of laminins. Annu Rev Cell Dev Biol. 2012;28:523–53
8.Rodin S, Domogatskaya A, Ström S, Hansson EM, Chien KR, Inzunza J, et al. Clonal culturing of human embryonic stem cells on laminin-521 supports stable self-renewal and differentiation. Nat Commun. 2014;5:3195
9.Hall A, Khan S, Naranjo JD, Hassell T. Laminin-411 enhances endothelial differentiation from human induced pluripotent stem cells. Front Cell Dev Biol. 2022;10:874003.


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













