
 发布时间:2026/02/05 点击数:14
发布时间:2026/02/05 点击数:14 以下内容为干货分享,如需肝细胞相关技术支持,可点击此处咨询曼博生物。
一、引言
在药物研发阶段,新型化合物对主要细胞色素P450(CYP)酶的体外诱导潜能评估是关键环节,传统方法多采用三明治培养的原代人肝细胞(PHH)。尽管PHH结合监管指南往往能较合理地预测临床诱导风险,但对于新一代的肝细胞模型在CYP诱导评估中的表现,目前仍缺乏充分认知。
本研究评估了一种新型的全人源肝细胞三培养系统(TCS),用于检测主要CYP和核受体的基础表达水平,以及在原型诱导剂处理后CYP的诱导水平。这些结果将为TCS在体外诱导研究中的进一步应用提供基础数据支持,并为探索TCS能否克服PHH存在的相关挑战(如CYP2C酶诱导评估难题)提供重要参考。
二、材料与方法
1、4周培养期内基因基础表达水平的评估
将原代人肝细胞(PHH)和饲养细胞接种到24孔胶原包被板上,构建三培养体系(TCS);
在4周培养期内的特定时间点,向孔中加入Trizol试剂裂解细胞;
采用氯仿萃取法分离RNA,使用SuperScript IV VILO试剂盒合成cDNA;
使用QuantStudio7实时荧光定量PCR系统上的TaqMan芯片检测法评估基因表达。与第1天的表达量相比,使用ΔΔCt法计算倍数变化。
2、评估CYP表达对原型诱导剂的反应
将原代人肝细胞(PHH)和饲养细胞接种到96孔胶原包被板上,构建三培养体系(TCS);
培养至第10天,向孔中加入含不同浓度原型诱导剂(含0.1%二甲基亚砜)的培养基(表1);
细胞暴露于诱导剂48小时,前24小时后更换新鲜培养基和诱导剂;
48小时后,移除培养基,使用mRNA Catcher PLUS纯化试剂盒收集各孔中的RNA;
采用Super Script IV VILO试剂盒合成cDNA,通过QuantStudio7实时荧光定量PCR系统结合TaqMan探针检测法评估基因表达水平,采用ΔΔCt法计算相对于溶媒对照组的倍数变化;
使用GraphPad Prism软件,通过S型曲线拟合数据来确定Emax和EC₅₀值。
表1.针对阳性诱导剂处理后诱导潜能评估的CYP酶列表
表2.肝细胞供体(1921756)信息
三、结果
1、三培养体系(TCS)研究中内参基因的筛选
结果显示,各内参基因的Ct值存在差异(图1)。其中GAPDH在培养期间的Ct值具有良好的一致性,因此被选为理想的内参基因。
图1.4周培养期内各内参基因表达水平的评估。每个圆点代表第1、4、7、12、17、23或30天的基因表达水平。
表3.各内参基因的Ct值统计数据
2、4周培养期内TCS中CYP酶和核受体的基础表达水平
如图2所示,在TCS建立后的4-12天内,除CYP1A1和CYP2E1外,其余CYP酶和核受体的表达水平均明显升高。大多数受测基因的表达水平在培养第7-12天达到峰值,因此后续的诱导研究选择在培养第10天启动。
图2.在基础培养条件下,于4周培养期内的不同时间点检测TCS中各CYP酶和核受体的基因表达水平。
3、原型诱导剂暴露48小时后主要CYP酶的诱导潜能
经不同浓度原型诱导剂处理48小时后,TCS中所有主要CYP酶均表现出明显的诱导潜能,包括CYP2C家族各亚型(图3)。各酶的最大诱导倍数(Eₘₐₓ)和半数效应浓度(EC₅₀)数据见表4。此外,在所有主要CYP酶的测试中,当诱导剂浓度达到最高值时,诱导潜能均呈现下降趋势。
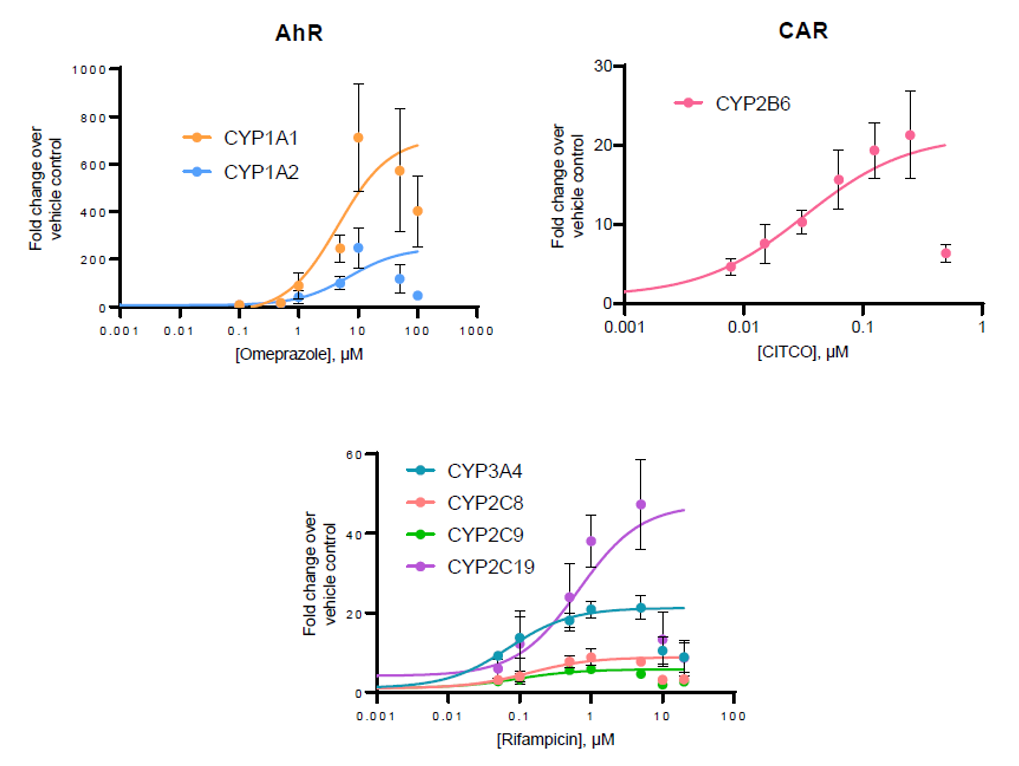
图3.三培养体系(TCS)经不同浓度的多种原型诱导剂处理48小时后,检测各CYP酶的基因表达水平。表达水平以相对于溶媒对照组的倍数变化表示(n=4),通过将曲线限定在观察到的最高倍数变化值,确定各酶的最大诱导倍数(Eₘₐₓ)和半数效应浓度(EC₅₀)
表4.各CYP酶的最大诱导倍数(Eₘₐₓ)和半数效应浓度(EC₅₀)
四、结论
TCS建立后的4-12天内,除CYP1A1和CYP2E1外,CYP酶和核受体的表达水平明显升高;
大多数受测基因在TCS中的表达水平于第7-12天达到峰值;
主要CYP酶在TCS中均对原型诱导剂具有高度诱导性,包括CYP2C酶;
在主要CYP酶的测试中,当诱导剂浓度达到最高值时,诱导潜能均有所下降。


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 














