
 发布时间:2025/10/30 点击数:357
发布时间:2025/10/30 点击数:357 英国Nuclera公司的eProtein Discovery是一个无细胞蛋白质合成(CFPS)系统,也被称作体外转录/翻译系统,能够快速获得高质量、功能性蛋白质,从DNA到活性蛋白质仅需48小时。

该系统采用数字微流控卡盒和定制试剂,可同时自动筛选多达24种可溶性蛋白或11种膜蛋白、每种蛋白最多8组不同的表达条件,筛选结果可直接应用于体内表达,有效指导大肠杆菌菌株选择和质粒设计,加速整体蛋白质生产流程。
一、引言
布鲁顿酪氨酸激酶(BTK)是B细胞受体信号通路中的关键分子,也是治疗白血病、淋巴瘤及自身免疫性疾病的重要靶点。第一代抑制剂(如伊布替尼)面临着耐药性(如C481S 突变导致的耐药)与脱靶效应问题;第二代抑制剂(如阿卡替尼、赞布替尼)虽提升了选择性,但仍受耐药性与生物利用度问题的困扰;非共价抑制剂(如非奈布替尼、维卡布替尼)虽对C481S突变型BTK仍有活性,但其与BTK的结合具有可逆性,因此需通过详细的动力学表征来评估其治疗潜力。
本研究展示了Nuclera公司与Cytiva公司合作开发的一体化解决方案,可将BTK抑制剂筛选从DNA阶段到功能表征阶段的流程缩短至5天。其中,eProtein Discovery系统能高效表达带Avi标签的BTK蛋白(产量高),而Biacore SPR技术可提供详尽的动力学与功能分析数据。这一简化的工作流程不仅提升了药物靶点的生产效率、加快了筛选速度,更助力激酶药物研发领域实现更快速、基于数据的决策。
二、工作流程
首先,利用整合了数字微流控技术与无细胞蛋白质合成技术的eProtein Discovery系统,筛选蛋白质的最佳表达与纯化条件;随后,将筛选出的最优条件进行规模放大,并对所得蛋白质进行生物素化修饰;在进行Biacore SPR分析前,需通过缓冲液交换去除样品中多余的生物素;最后,将生物素化的蛋白质直接捕获到Sensor Chip SA上,借助 Biacore 1S+系统完成药物-靶点相互作用的表征分析。
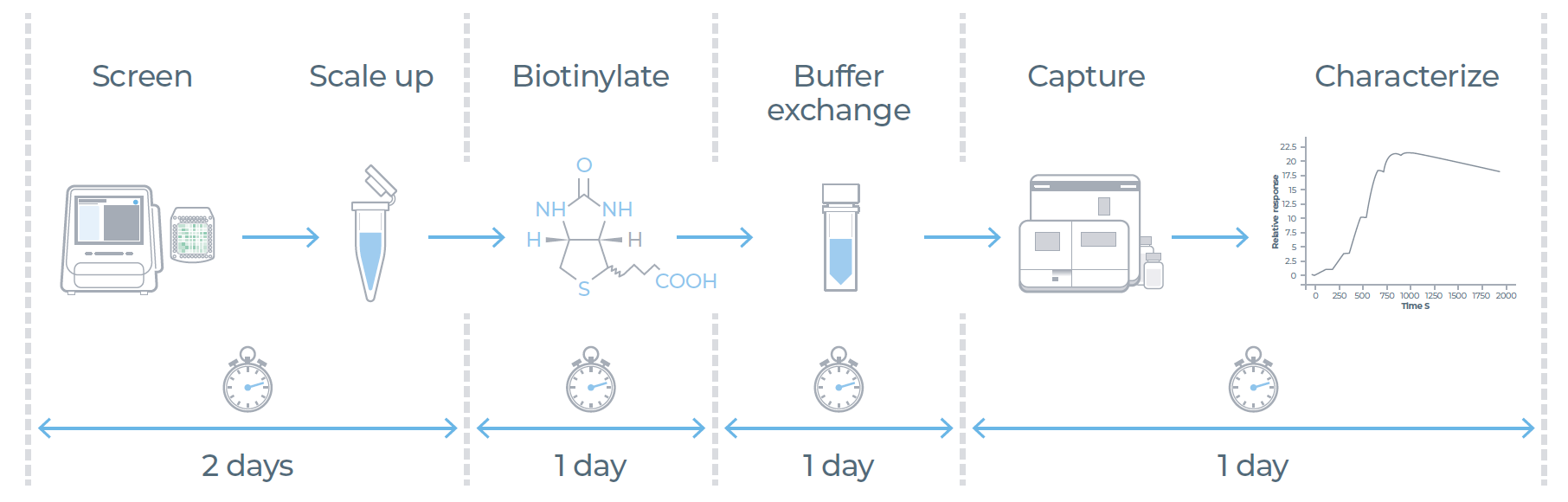
图1:5天工作流程实现从DNA到蛋白质表征。
三、方法
1、利用eProtein Discovery系统筛选并放大生产蛋白质
通过eProtein Discovery系统对三种 BTK 基因片段(包括全长片段 1-693、截短变体 211-659,以及单独的激酶结构域 392-659)进行筛选,评估其在不同可溶性标签与无细胞表达条件(无细胞混合体系,Cell-free Blends)组合下的可溶性表达水平与纯化产量。筛选后,选择产量最高的构建体BTK392-659,在其N端和C端分别引入Avi标签,并重复上述筛选过程。随后,对优化后的构建体进行规模放大生产,最终通过SDS-PAGE验证蛋白质的产量与纯度。
2、生物素化修饰
采用 BirA 连接酶对纯化后的带Avi标签BTK蛋白进行生物素化修饰,修饰完成后,使用 Zeba离心脱盐柱进行缓冲液交换,去除样品中多余的生物素与BirA连接酶。通过 SDS-PAGE与Streptavidin-A488免疫印迹法验证生物素化修饰是否成功。
3、利用Biacore SPR系统捕获并表征蛋白质
本研究使用Biacore 1S+系统开展 BTK 蛋白的捕获与表征实验。
在HBS-P+运行缓冲液中,将浓度为 15-20 μg/mL 的生物素化 BTK 蛋白在 25℃条件下,以 5 μL/min的流速、720秒的接触时间,捕获到Sensor Chip SA或Sensor Chip NA上。采用 Biacore SCK检测法,分析BTK蛋白与抑制剂vecabrutinib、fenebrutinib的结合动力学特征:先将生物素化 BTK 蛋白固定在 Sensor Chip NA 上,固定水平最高达 2000 RU;随后,将抑制剂以 3 倍稀释梯度配制为0.4 nM至100 nM 的系列浓度,在25℃条件下以30 μL/min的流速注入系统,设定结合时间为120秒、解离时间为1200秒。实验中,运行缓冲液与样品制备均使用pH 7.4的HBS-P+缓冲液,该缓冲液含 10 mM MgCl₂与 5% DMSO。
四、数据与讨论
1、借助eProtein Discovery系统可快速筛选出适用于 Biacore 系统 SPR 分析的蛋白变体
为评估BTK蛋白的表达情况,研究人员首先利用AlphaFold软件设计了三种BTK构建体(图 2A),随后通过eProtein Discovery系统,在一组不同的可溶性标签与无细胞混合体系条件下对这些构建体进行筛选。
结果显示:仅含BTK激酶结构域的变体(BTK392-659)在融合FH8标签后,其表达量是全长BTK蛋白(BTK1-693)的 9 倍(图 2B);纯化效率也呈现相似趋势,BTK392-659 的纯化蛋白产量是全长 BTK 的 5 倍(图 2C)。这一结果充分证明,通过对蛋白构建体(如选择特定结构域、搭配可溶性标签)进行优化,能明显提升蛋白质的产量与稳定性。
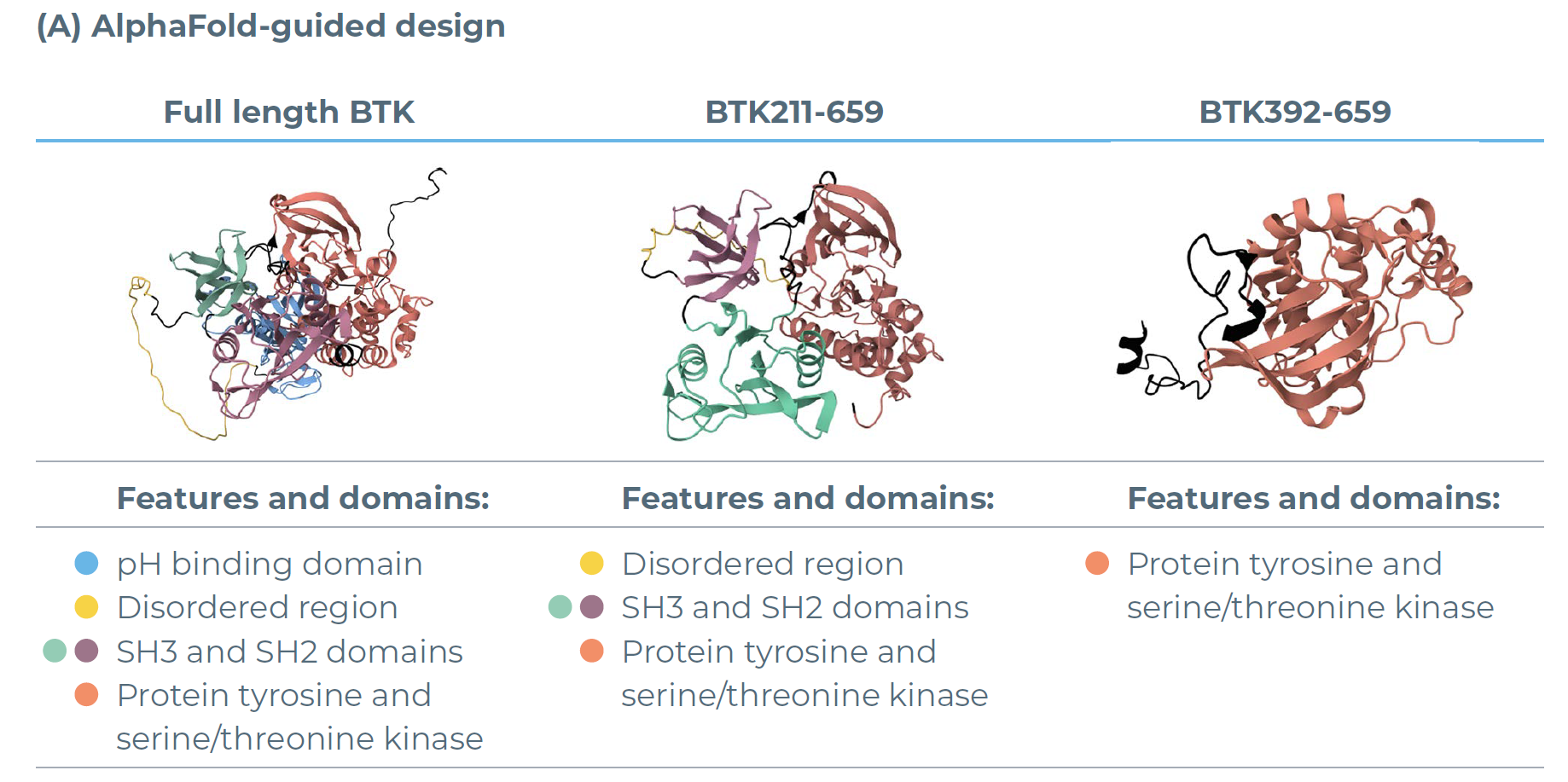
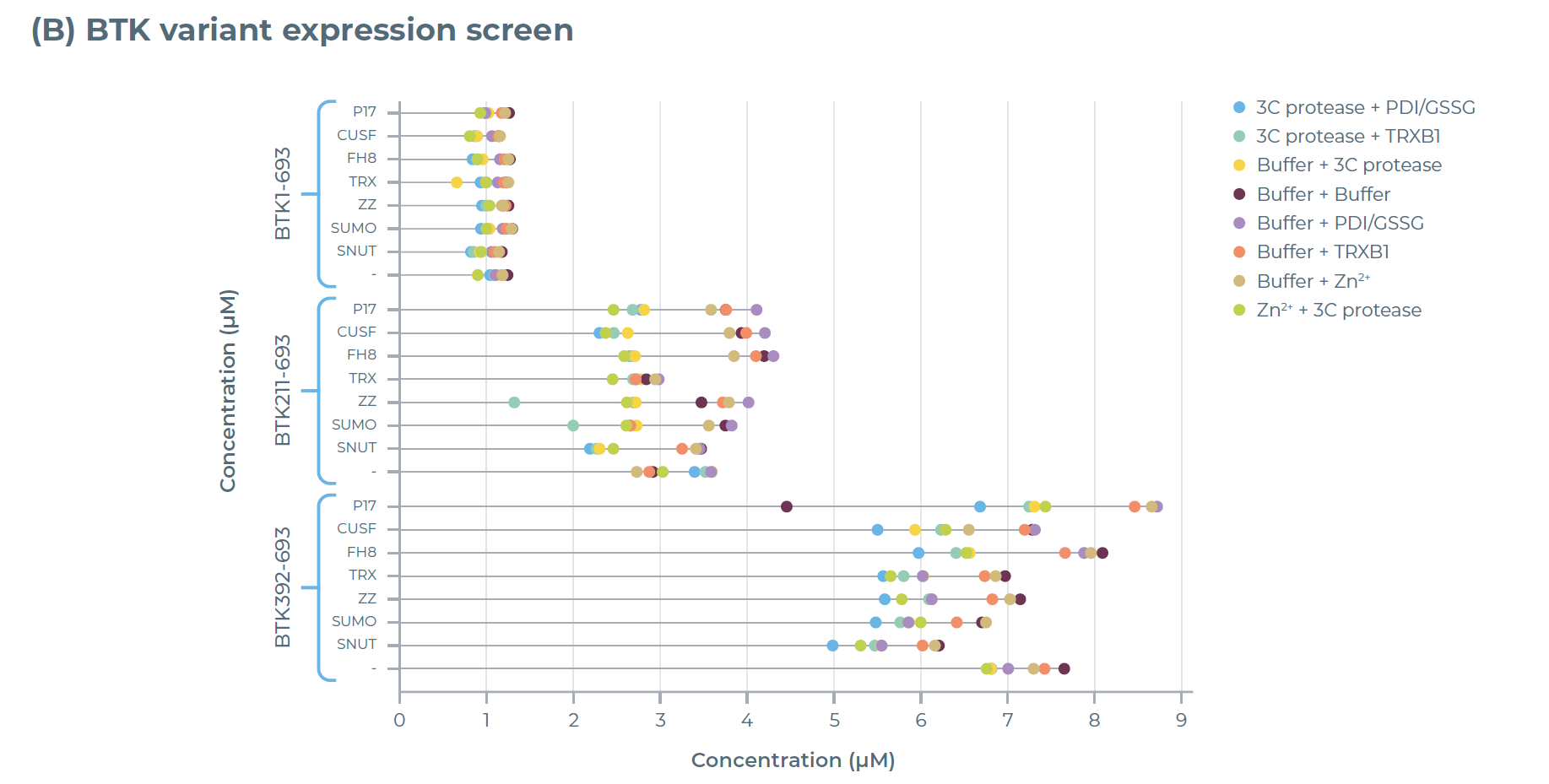
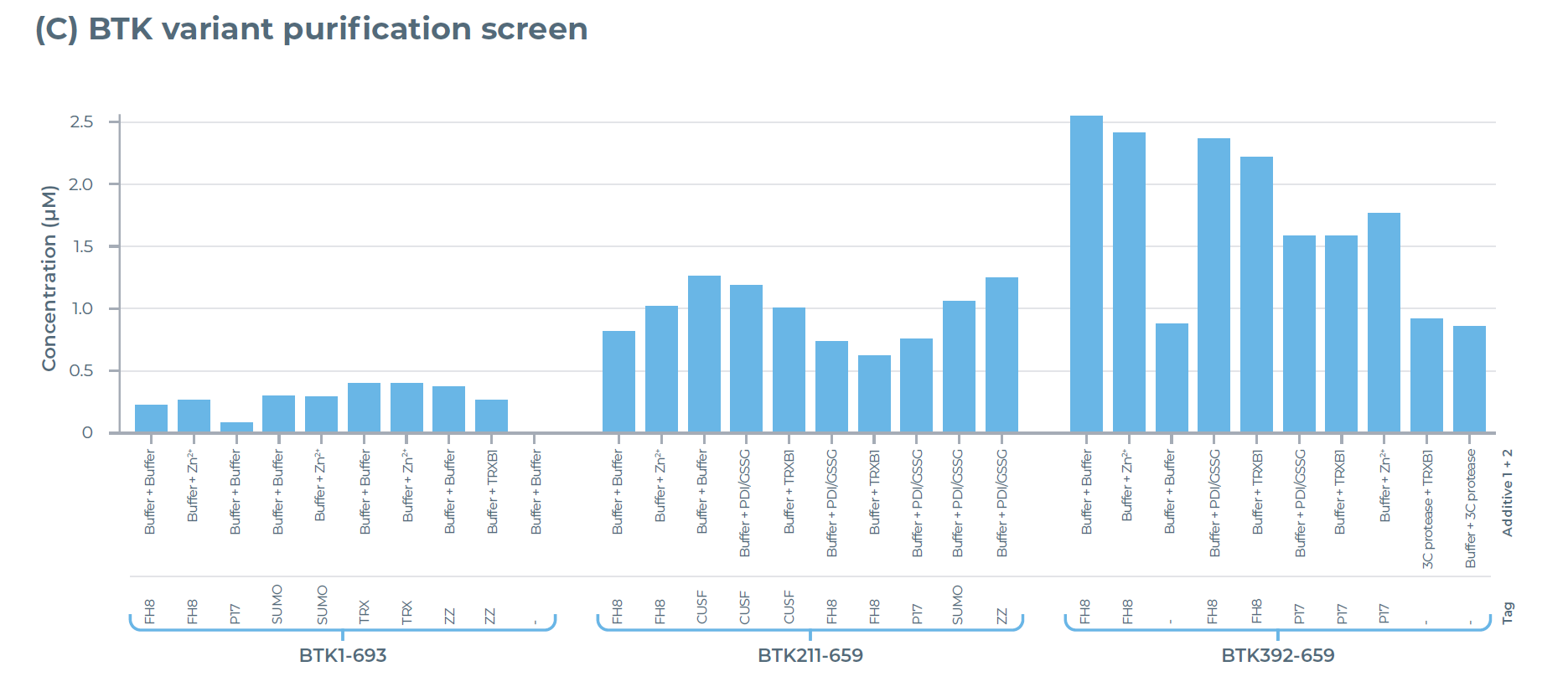
图2:利用eProtein Discovery系统对BTK变体进行表达与纯化筛选。(A)所筛选BTK变体的AlphaFold结构预测图。(B)192种条件下的表达筛选结果:在8种添加了不同添加剂的无细胞混合体系中,对携带7种可溶性标签的BTK变体及1组无标签对照组的表达情况进行评估。(C)30种选定条件下的纯化筛选结果:通过这些条件评估BTK变体的纯化产量与可溶性。
2、优化Avi标签位置
研究人员将 Avi 标签分别引入 BTK392-659 蛋白的N端和C端(图 3A),以评估标签位置对蛋白生产的影响。结果显示,蛋白表达量较之前(图2B中为6-8 μM)略有下降,降至5-6 μM(图 3B)。但 Avi 标签的放置位置并未对蛋白的表达与纯化产生不利影响,两种标签位置(N端、C端)对应的蛋白预测纯化产量均为2.5 μM(图 3C)。
此外,仅添加Buffer仍是最优的添加剂条件;但与此前不同的是,本阶段实验中,ZZ可溶性标签而非 FH8标签实现了蛋白产量最大化,这一结果进一步印证了可溶性标签筛选的重要性。
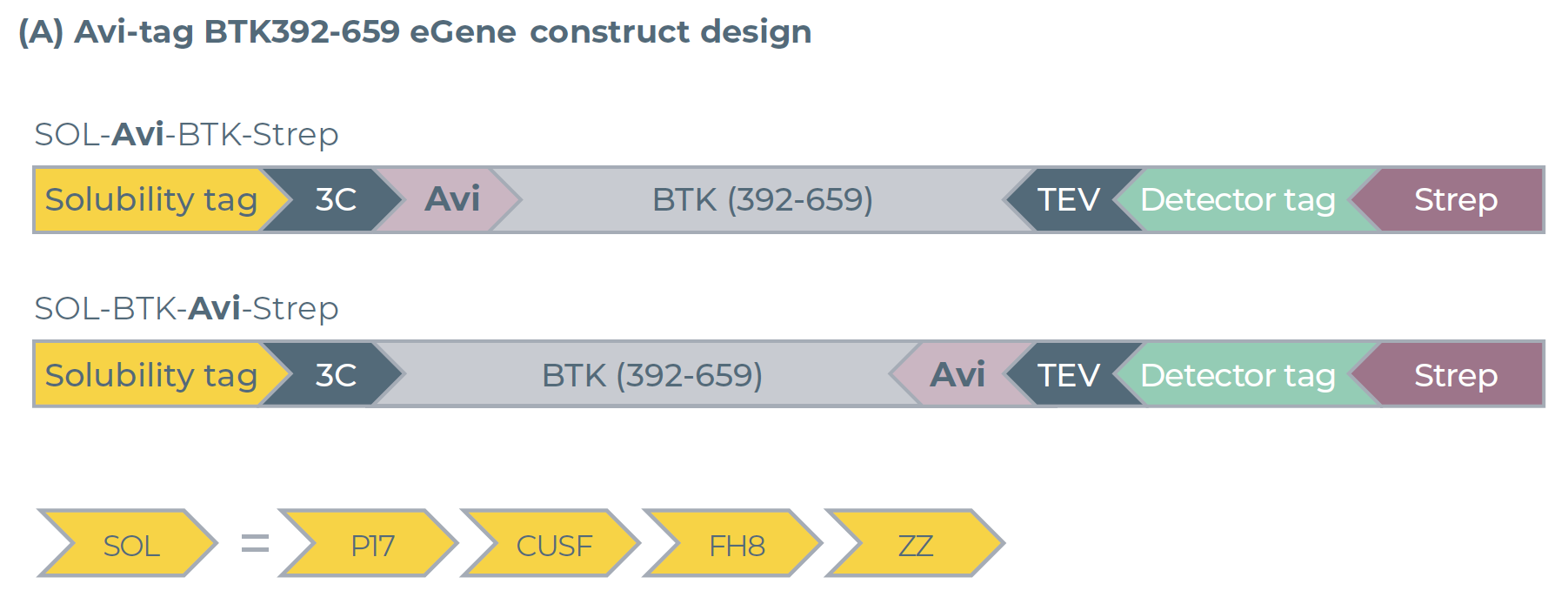
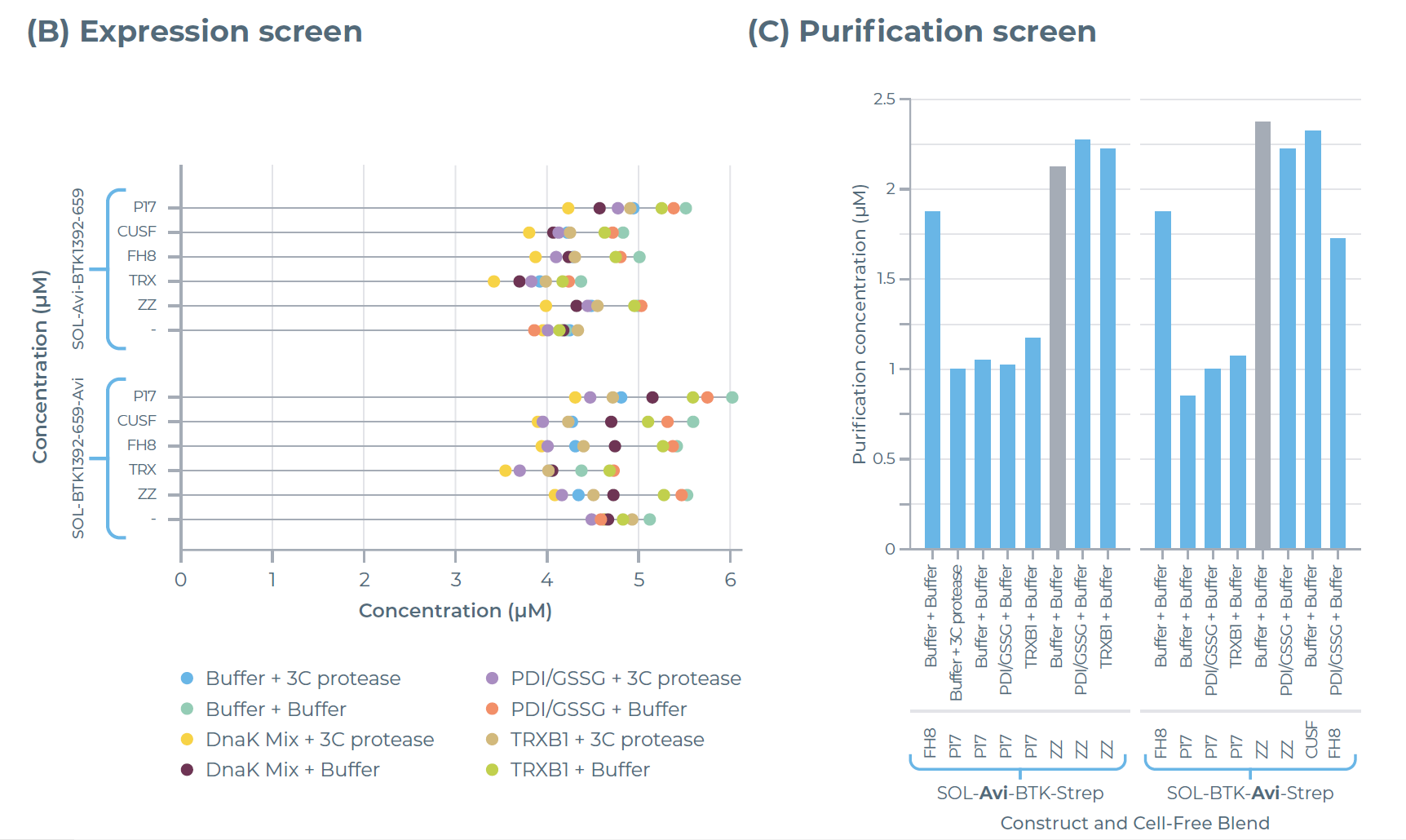
图3:利用eProtein Discovery系统对带Avi标签的BTK392-659蛋白进行表达与纯化筛选。(A)N端和C端带 Avi标签的BTK392-659变体的eGene构建体设计图。(B)表达筛选结果与(C)纯化筛选结果:在 8 种无细胞混合体系(Cell-free Blends)中,对携带7种可溶性标签的 Avi-tagged BTK392-659 及 1 组无标签对照的表达水平、纯化效果分别进行检测;(C)中的灰色柱形代表被选定用于后续规模放大生产的实验条件。
3、带Avi标签的BTK蛋白规模放大生产与生物素化修饰
研究人员将两种含 ZZ可溶性标签的带 Avi 标签 BTK392-659 变体,在 “仅含Buffer” 的无细胞混合体系中进行规模放大生产,最终获得了纯度合格、浓度为250 μg/mL的纯化蛋白(图 4)。

图4:利用eProtein Discovery系统对规模放大生产的带Avi标签BTK392-659蛋白进行 SDS-PAGE 分析结果。(A)N 端带 Avi 标签的 BTK 蛋白;(B)C 端带 Avi 标签的 BTK 蛋白。
采用 BirA 连接酶对带 Avi 标签的 BTK 蛋白进行生物素化修饰,随后通过三轮缓冲液交换去除多余的生物素。Western blot分析证实,N 端和 C 端带 Avi 标签的 BTK 蛋白均成功实现生物素化,与未生物素化的对照样品相比,二者均呈现出强烈的链霉亲和素信号(图 5)。该实验流程仅需极短的处理时间,即可获得可用于 SPR 分析的蛋白。
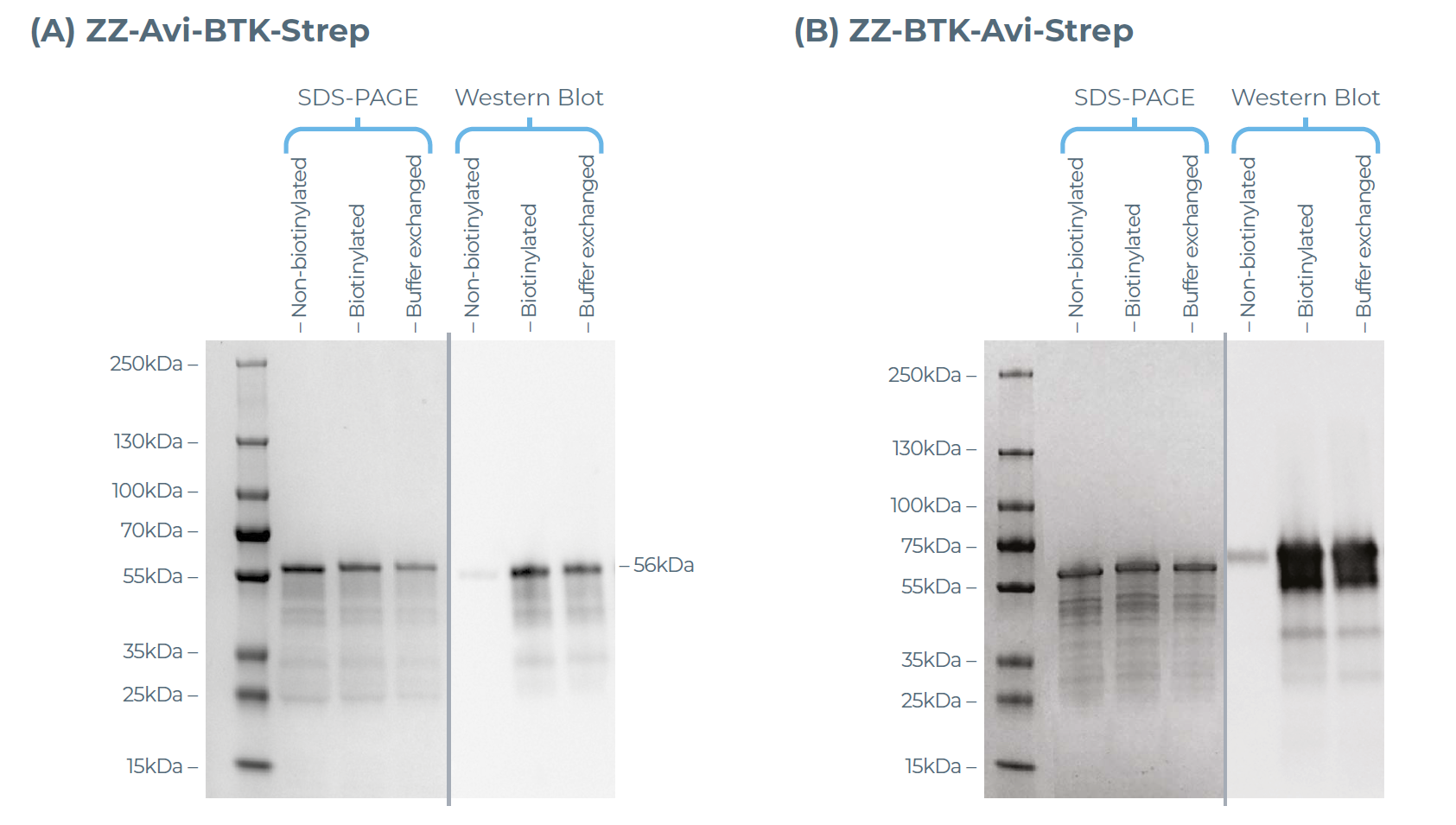
图5:采用Streptavidin-A488对N端和C端带Avi标签的BTK392-659蛋白的生物素化情况进行Western blot分析。(A)N 端带 Avi 标签的 BTK 蛋白;(B)C 端带 Avi 标签的 BTK 蛋白。
4、利用Biacore SPR系统快速捕获并表征BTK变体
研究人员通过Sensor Chip SA与Sensor Chip NA,分析了Avi标签及生物素化修饰分别位于 N 端和 C 端的 BTK 变体的捕获效率。图 6A 显示了两种变体在 Sensor Chip SA 上的捕获水平响应结果:N 端生物素化的 BTK 在两种芯片上均表现出良好的捕获水平,而 C 端生物素化的 BTK 结合水平较差,这可能是空间位阻导致的。在 Sensor Chip NA 上也观察到了类似的捕获水平(数据未展示)。这种简单的 Biacore 捕获实验,可快速证明通过实验优化标签位置的重要性。
研究人员选择N端生物素化的BTK变体,进一步开展其与抑制剂fenebrutinib和vecabrutinib的动力学研究。采用 Biacore SCK检测法分析BTK与抑制剂的结合动力学,并使用 Biacore Insight Evaluation 软件进行数据分析。图6B展示了fenebrutinib和vecabrutinib与固定在 Sensor Chip NA 上的 BTK 的结合情况,证实了eProtein Discovery系统表达的 BTK 对其抑制剂具有活性。fenebrutinib与商用BTK的结合曲线也呈现出类似特征(数据未展示)。
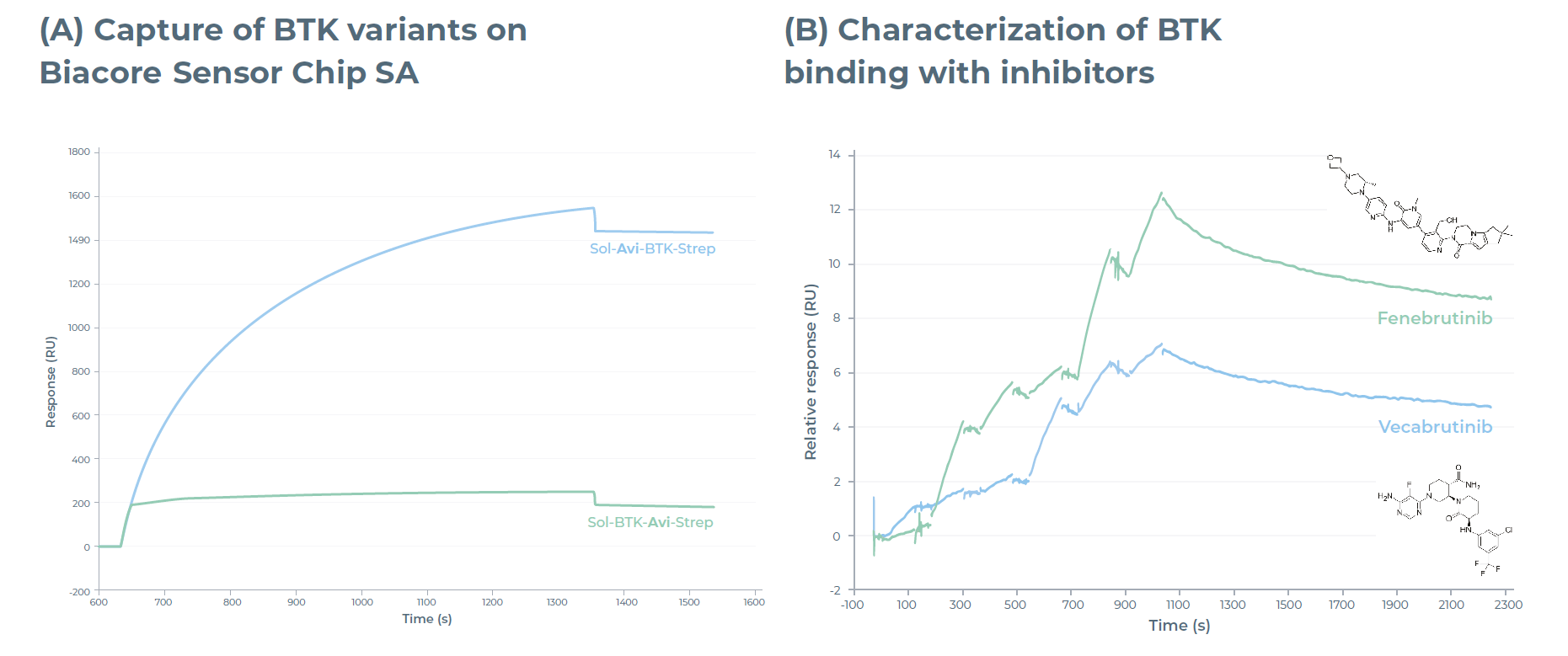
图6:(A)N端和C端带Avi标签的BTK392-659变体在Sensor Chip SA上的Biacore SPR 传感器图。(B)Fenebrutinib和vecabrutinib与N端生物素化BTK(SOL-Avi-BTK392-659)结合的Biacore 单循环动力学传感器图。
五、结论
在药物研发中,理解药物与靶点相互作用的构效关系至关重要,因为它直接影响药物的疗效与选择性。本研究展示了一套经过优化的高效工作流程,可用于快速生产和表征布鲁顿酪氨酸激酶(BTK)。
通过将Nuclera公司的eProtein Discovery系统与Cytiva公司的Biacore SPR技术相结合,研究人员能在 5 天内完成药物靶点的筛选、规模放大、捕获与表征工作,大幅加快了抑制剂筛选与先导化合物优化的进程。最终,这一新一代技术方案为药物研发提供了更快速、基于数据的决策支持,助力加速开发出选择性更强、疗效更优的激酶抑制剂。


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













