
 发布时间:2025/12/23 点击数:881
发布时间:2025/12/23 点击数:881 摘要
本研究利用垂直轮生物反应器,成功将iPSC有效分化为功能性胰岛(SC-islets)。这些胰岛在细胞组成、代谢功能和转录成熟度上与成人供体胰岛相似,且在葡萄糖刺激下能有效分泌胰岛素。单细胞分析显示无异质性,移植后小鼠血糖稳态恢复,移植物功能成熟。该技术有助于规模化生产临床级别的胰岛,为糖尿病治疗提供新途径。

一、研究背景
糖尿病是一种全球性健康问题,影响着数亿人的生活。传统的治疗方法,如胰岛素注射和生活方式调整,虽然能够控制血糖水平,但无法根治糖尿病。干细胞疗法,尤其是从多能干细胞中分化出的胰岛,为糖尿病的治疗提供了新的思路。这些胰岛能够模拟人体内的胰岛功能,有望恢复患者的胰岛素分泌能力。
二、研究方法
研究团队采用了垂直轮生物反应器系统,这是一种高度可控和动态的细胞培养环境,能够促进细胞的生长和定向分化。该系统通过准确控制氧气、营养物质水平、pH值和机械刺激等参数,模拟胰腺的动态和异质性微环境,从而促进细胞的分化和成熟。
研究中使用的人类诱导多能干细胞(iPSCs)来源于健康供体的外周血单个核细胞(PBMCs)。这些iPSCs在PBS垂直轮生物反应器中进行扩增,并在反应器中通过六个阶段分化方案(S1至S6)分化为胰岛。每个阶段都通过特定的生长因子和抑制剂进行调控,以确保细胞的有效分化。(详细方案见原文章:Complete Suspension Differentiation of Human Pluripotent Stem Cells into Pancreatic Islets Using Vertical Wheel? Bioreactors。doi.org/10.1101/2023.08.09.552676)
三、实验结果
1、人iPSC可在垂直轮式生物反应器中定向分化均一的SC-胰岛细胞簇
在0.5L垂直轮生物反应器中,iPSCs的扩增达到了9.971亿个细胞,平均簇大小为250微米。通过完整的悬浮分化方案,iPSCs在垂直轮生物反应器中有效分化为胰岛,最终产量达到了1.35亿个SC-islet细胞。
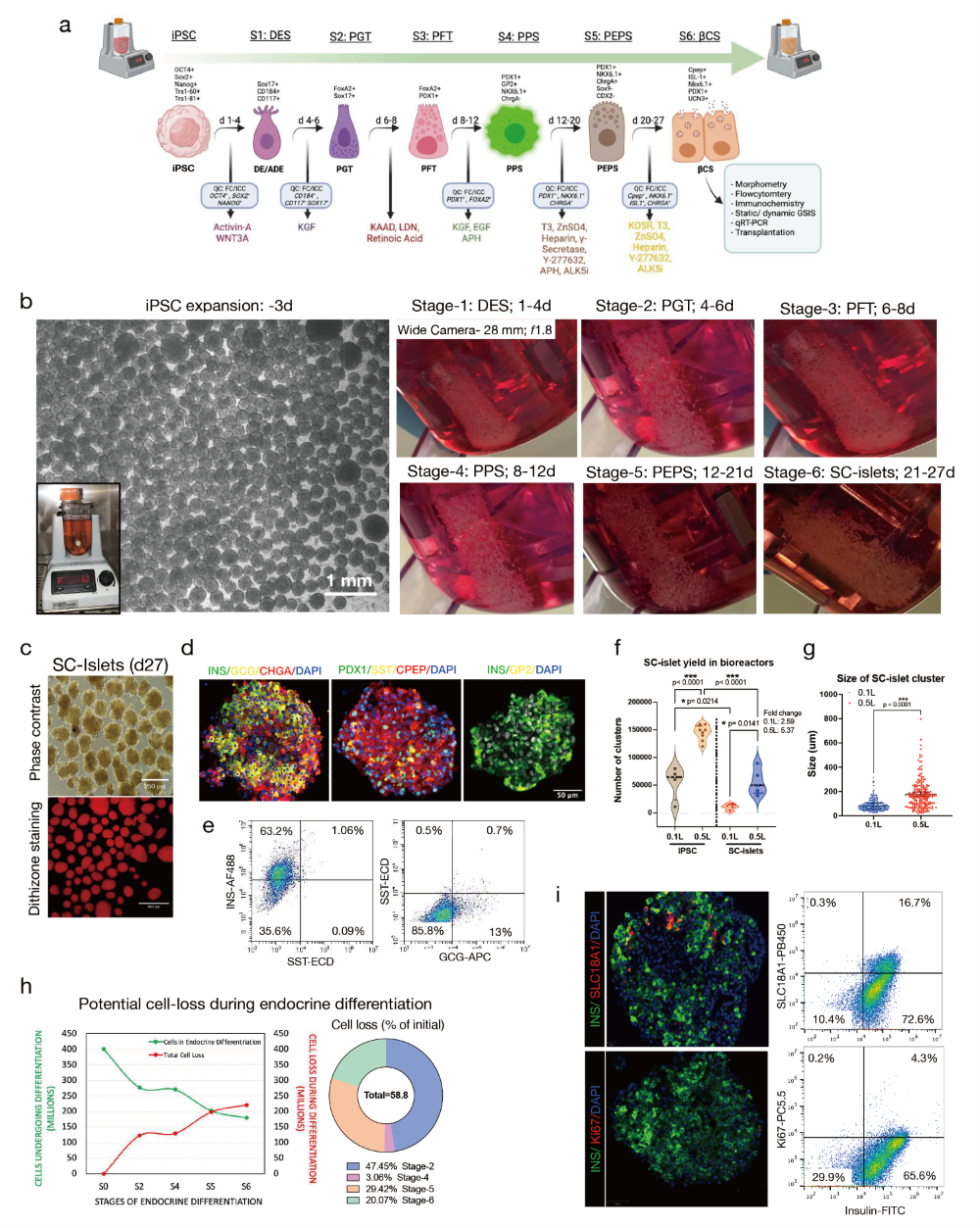
图1. 垂直轮生物反应器中iPSC衍生胰岛的完全悬浮培养分化与特性鉴定
a. 27天六阶段悬浮培养分化协议的概览,使用垂直轮生物反应器,每个阶段都有质量控制放行参数和特定阶段的生长因子。阶段1-7分别称为:DES(确定性内胚层)、PGT(原始肠管)、PFT(后前肠)、PPS(胰腺祖细胞)、PEPS(胰腺内分泌祖细胞阶段)、bCS(β细胞阶段)。
b. 在垂直轮生物反应器中扩增的iPSC聚集体的相差图。比例尺为1毫米。插图显示了在扩增周期中培养的0.1L 反应器中的iPSCs。照片显示了从第1天到第27天每个分化阶段结束时在垂直轮生物反应器容器底部聚集的细胞团。
c. SC-胰岛的相差和明场图像,用于形态学观察和二硫腙染色(红色)。比例尺分别为250微米和800微米。
d. S6培养期间SC-胰岛的免疫组化图像。比例尺为50微米。e. 胰岛激素细胞(胰岛素、胰高血糖素和生长抑素)的代表性流式细胞术图。
f. 在0.1L和0.5L生物反应器容器中SC-胰岛(S6)产量的量化。
g. 从0.1L和0.5L生物反应器容器中生成的SC-胰岛簇大小的量化。
h. 细胞在S1-S6胰岛分化阶段经历内分泌分化及可能发生的细胞损失的图形表示。整个图表的各部分代表每个阶段的总细胞损失。
i. SC-胰岛簇的免疫组化图像和代表性流式细胞术,用于检测S6期间非靶向SC-肠嗜铬细胞(EC)和增殖的Ki-67阳性细胞的比例。
2、对细胞簇进行细胞组成分析证实,iPSC可有效分化为胰腺谱系细胞
生成的SC-islets显示出丰富的内分泌细胞组成,约63%的细胞为CPEP+NKX6.1+ISL1+,显示出功能性成熟,能够在体外和移植后对葡萄糖刺激的胰岛素分泌反应(约5倍)。
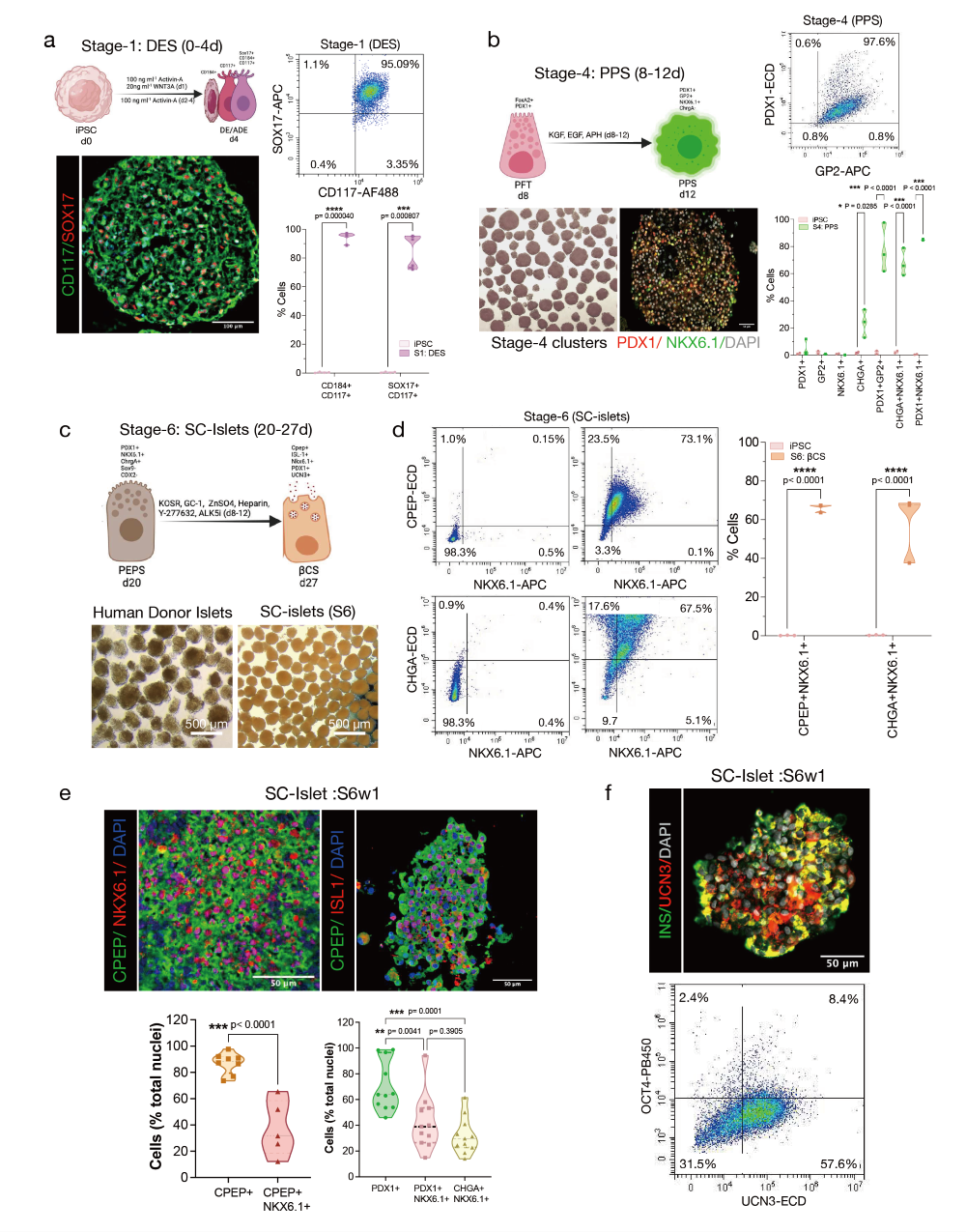
图2. 悬浮培养分化过程中SC-胰岛的阶段特异性细胞组成特征
a. 确定性内胚层(阶段1)簇的免疫组化图像及内胚层细胞比例的代表性流式细胞术图。比例尺为100微米。
b. 阶段4细胞簇的明场和免疫组化图像以及胰腺祖细胞比例的代表性流式细胞术图。比例尺为50微米。
c. 人类供体胰岛和完全分化的SC-胰岛簇的明场图像。比例尺为500微米。
d. S6分化后胰岛细胞比例的代表性流式细胞术图。通过流式细胞术对CPEP、NKX6.1和CHGA进行定量。e. 分化后的S6w1簇的免疫组化图像。比例尺为50微米。对S6w1时免疫染色簇的CPEP、NKX6.1、PDX1和CHGA进行定量。
f. 分化后的S6w1簇的免疫组化图像以及成熟(UCN3)和未分化(OCT4)标志物比例的代表性流式细胞术图。比例尺为50微米。
3、高维单细胞数据的动态可视化解析揭示了SC-祖细胞 (S4) 和 SC-胰岛 (S6) 的细胞异质性和表型多样性
通过单细胞质量流式细胞术和降维分析,研究团队在S4和S6阶段确认了细胞的理想成熟度。总的来说,来自 S4 和 S6 细胞的 FlowSOM 热图描绘了细胞群的分布及其胰腺祖细胞、胰腺内分泌祖细胞和激素分泌标志物的表达水平。值得注意的是,自组织映射中亚群的最小扩散反映了细胞组成中有限的细胞异质性。(详细分析见原文)
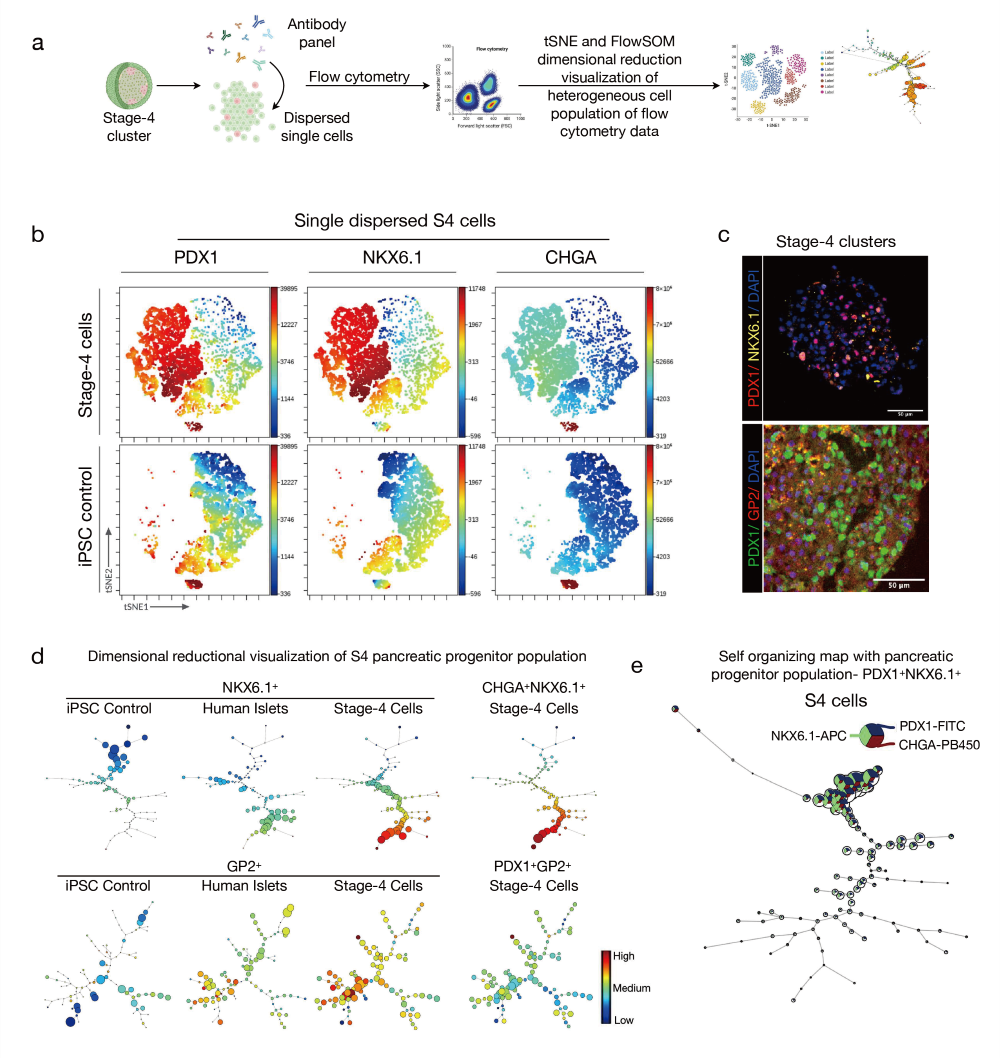
图3. SC-胰腺祖细胞中细胞异质性的单细胞viSNE和降维可视化
a. 实验设计概览,用于对S4细胞进行单细胞质量流式细胞术和细胞异质性的降维分析。
b.第4阶段50,000个祖细胞的单细胞viSNE图,显示PDX1、NKX6.1和CHGA标记物,与未分化的iPSC对照细胞对比。颜色梯度表示viSNE岛屿中细胞密度,从高(红色)到低(蓝色)。
c. S4细胞簇的免疫组化图像。比例尺为50微米。
d. S4胰腺祖细胞的流式细胞术的降维可视化(FlowSOM),针对NKX6.1、PDX1、GP2和CHGA,与供体原代胰岛细胞和未分化的iPSC对照细胞对比。颜色梯度表示内分泌谱系轨迹中细胞密度,从高(红色)到低(蓝色)。
e. S4细胞中PDX1、NKX6.1和CHGA的单细胞分辨率的自组织星形图。 自组织图的最小生成树显示基于蛋白表达水平的样本无监督聚类(右侧)。热图比例尺显示细胞簇中每个蛋白标记的表达水平(左侧)。
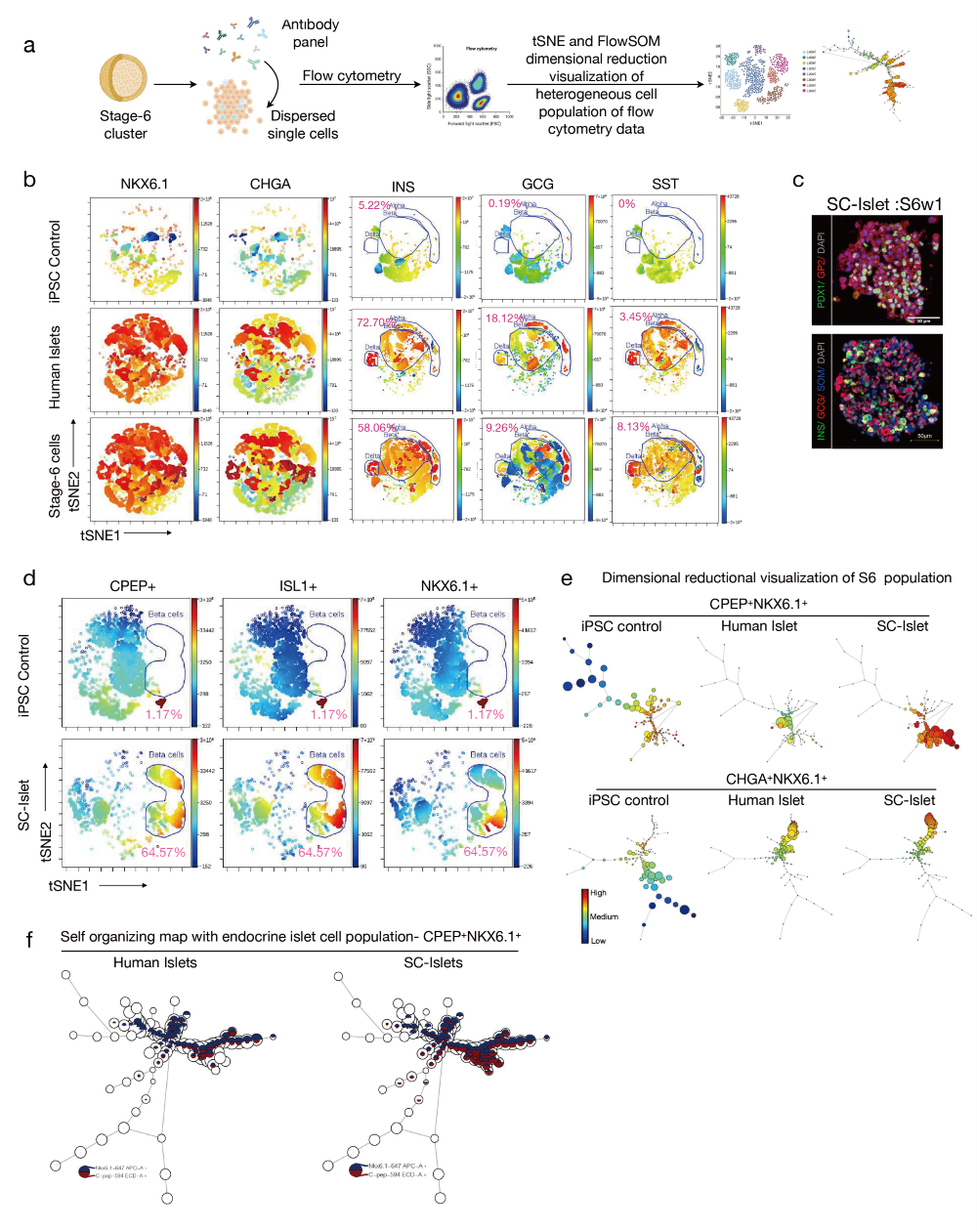
图4. SC-胰岛细胞中细胞异质性的单细胞viSNE和降维可视化
a. 实验设计概览,用于对SC-胰岛细胞进行单细胞质量流式细胞术和细胞异质性的降维分析。
b. 单细胞viSNE图显示了50,000个S6w1细胞在NKX6.1、CHGA以及胰岛激素INS、GCG和SST的表达情况,并与初级供体胰岛细胞和未分化的iPSC对照细胞进行了比较。颜色渐变表示viSNE岛屿中细胞的密度,从高密度(红色)到低密度(蓝色)。
c. S6w1簇的免疫组织化学染色。标尺,50 μm。
d. S6w1岛屿中CPEP、NKX6.1和ISL1的viSNE表示及定量分析,与iPSC对照组进行比较。颜色渐变表示viSNE岛屿中细胞的密度,从高密度(红色)到低密度(蓝色)。
e. S6w1细胞CPEP和NKX6.1的流式细胞术维度缩减可视化(FlowSOM),与供体初级胰岛细胞和未分化的iPSC对照细胞进行比较。颜色渐变表示内分泌谱系轨迹中细胞的密度,从高密度(红色)到低密度(蓝色)。f. 单细胞分辨率下的自组织星形图,显示CPEP和NKX6.1标记物。自组织映射的最小生成树展示了基于蛋白质表达水平的样本无监督聚类(右)。热图尺度显示了每个蛋白标记在细胞簇中的表达(左)。
4、悬浮培养的SC-胰岛在体外实现转录组学上的成熟
通过TaqMan低密度基因阵列(TLDA)卡进行的内分泌转录组分析显示,SC-islets的转录组与成人供体胰岛相似,表明SC-islets在转录水平上已经成熟。
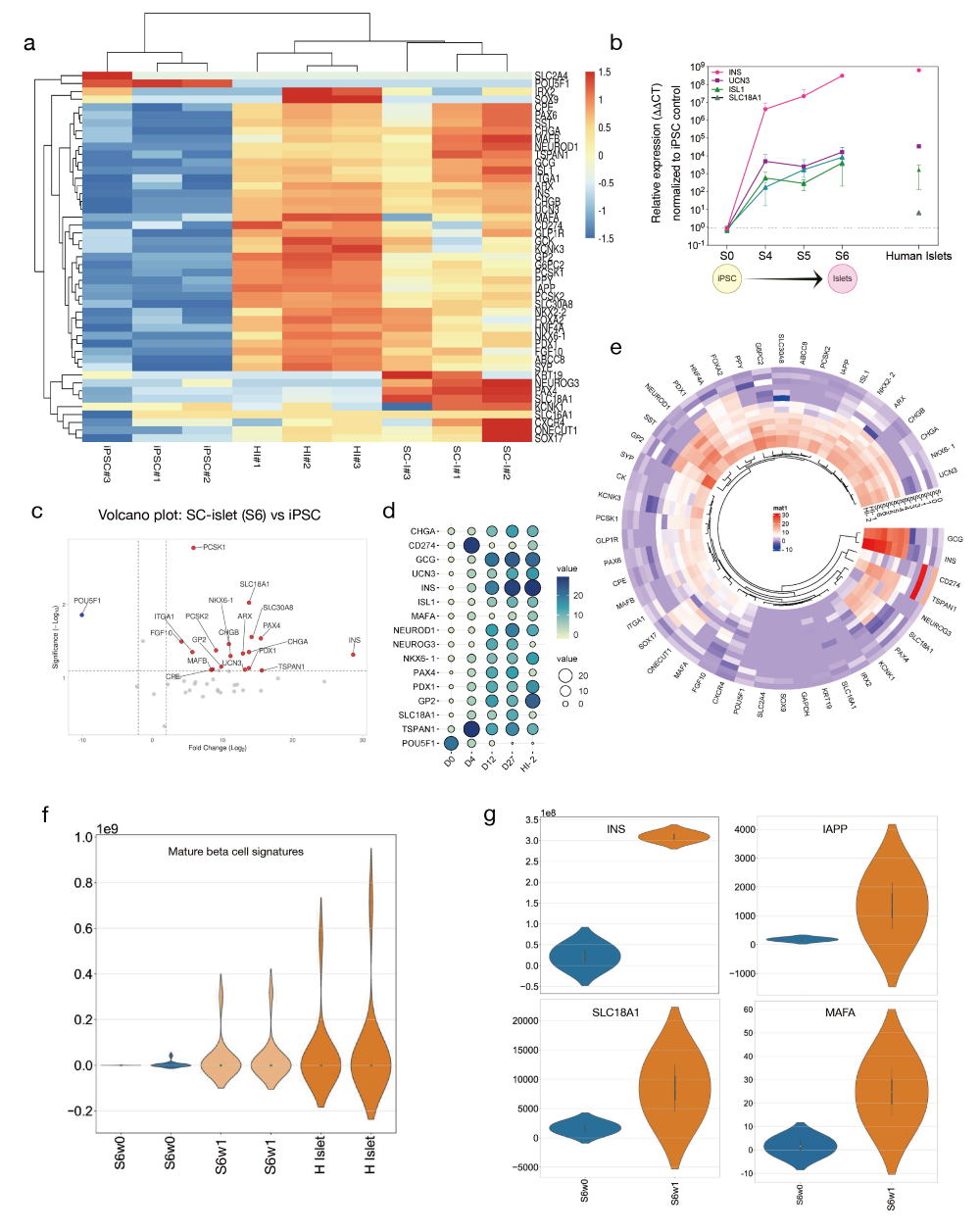
图5. 干细胞衍生胰岛的转录成熟
a. 热图展示SC-胰岛与原代胰岛及未分化iPSCs相比的胰岛分化基因簇。
b. 实时表达分析,显示从iPSCs分化至S6阶段过程中上调的选定基因。
c. 火山图展示SC-胰岛与未分化iPSCs对比,以显示体外上调和下调的关键基因集。
d. 关键胰岛特异性基因集随分化阶段进展上调的气泡图(左侧)。热图颜色比例尺(右上角)显示基因表达水平,气泡大小指标(右下角)代表分化各阶段每种转录本的密度。
e. 循环聚类热图展示从阶段0、1、3、4、5和6与原代供体胰岛相比,所有与胰腺分化相关的基因的平均表达水平,每个阶段n=2。热图比例尺显示基因表达水平(>0表示上调,<0表示下调)。
f. 小提琴图展示S6w1细胞的SC-胰岛与成人人类胰岛及未成熟S6w0细胞相比的成熟β细胞特征。
g. 小提琴图展示S6w1细胞从起源时间起与成熟β细胞标志性过程相关的基因表达水平。
5、悬浮培养的SC-胰岛具备功能性胰岛素分泌机制
SC-islets在静态和动态葡萄糖响应性胰岛素释放实验中显示出成熟的胰岛素分泌能力。在高葡萄糖(16.7 mM)和KCl去极化条件下,S6w1胰岛显示出明显的胰岛素分泌增加。
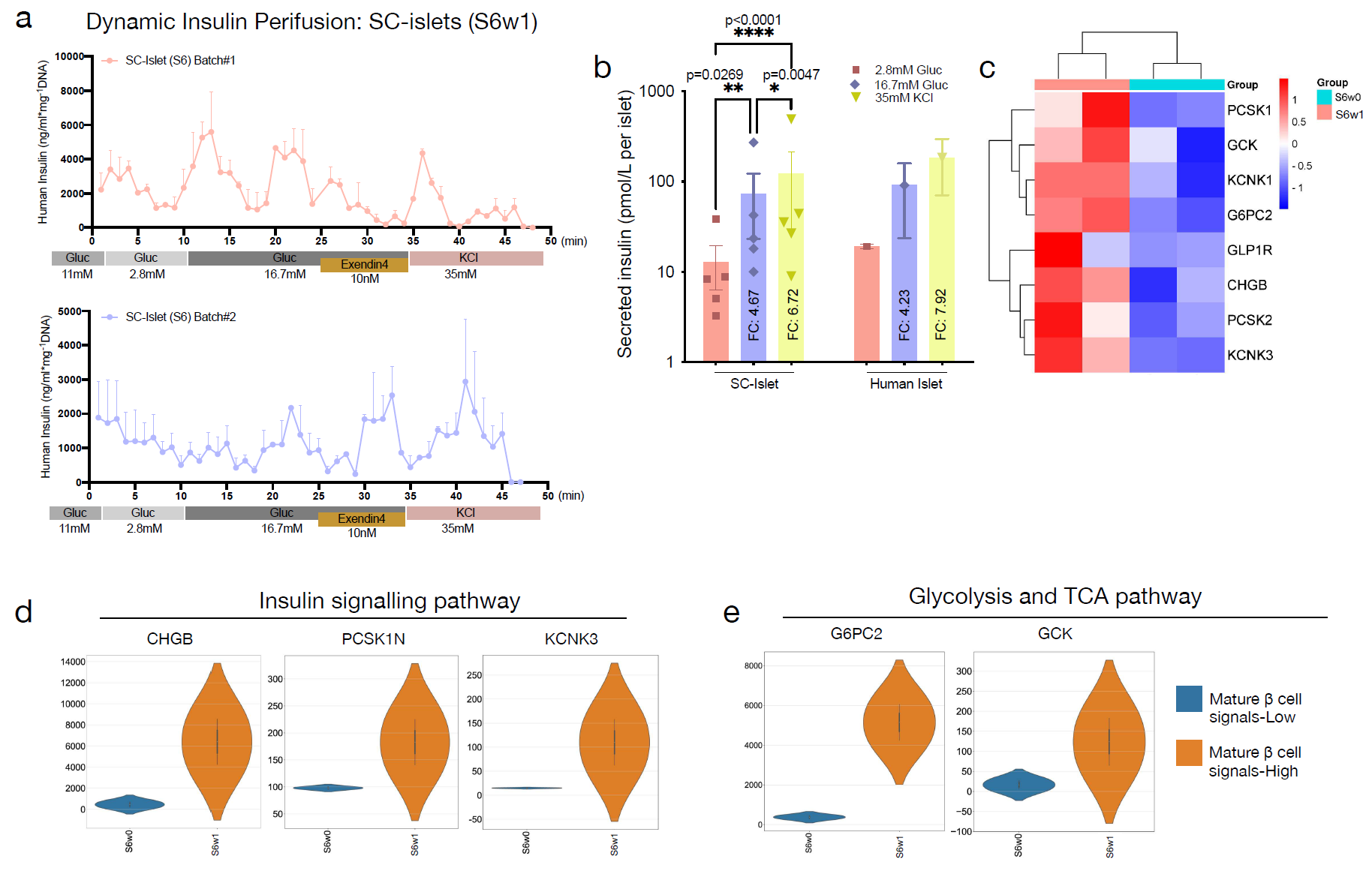
图6. 干细胞衍生胰岛的功能表型
a. 对11 mM(G11)、2.8 mM(G3)、16.7 mM(G17)葡萄糖、10 ng/ml艾塞那肽(EX4)和35 mM KCl的动态灌流的胰岛素分泌反应。分泌追踪结果根据总DNA含量进行标准化(n=3),来自两个独立分化批次复制的五十个S6w1簇。
b. S6w1簇在静态孵育中对不同葡萄糖浓度从G3到G17和KCl的胰岛素分泌反应与成人供体胰岛相比。结果根据每个用于释放实验的胰岛进行标准化,n=5。成人供体胰岛的技术复制平均分泌,n=2。
c. 热图展示S6w1细胞与未成熟S6w0细胞相比,与成熟β细胞标志性过程、葡萄糖代谢和功能相关的基因表达谱。
d-e. 小提琴图展示负责胰岛素分泌、氧化磷酸化、糖酵解和TCA循环途径的基因的平均表达。
6、人胰腺祖细胞与 SC-胰岛移植后可有效逆转小鼠高血糖症
将S4和S6w1细胞移植到链脲佐菌素(STZ)诱导的糖尿病免疫缺陷SCID beige小鼠的肾包膜下,结果显示S6w1移植小鼠在移植后42天内血糖水平迅速下降,并在105天内稳定控制血糖,明显优于S4细胞。
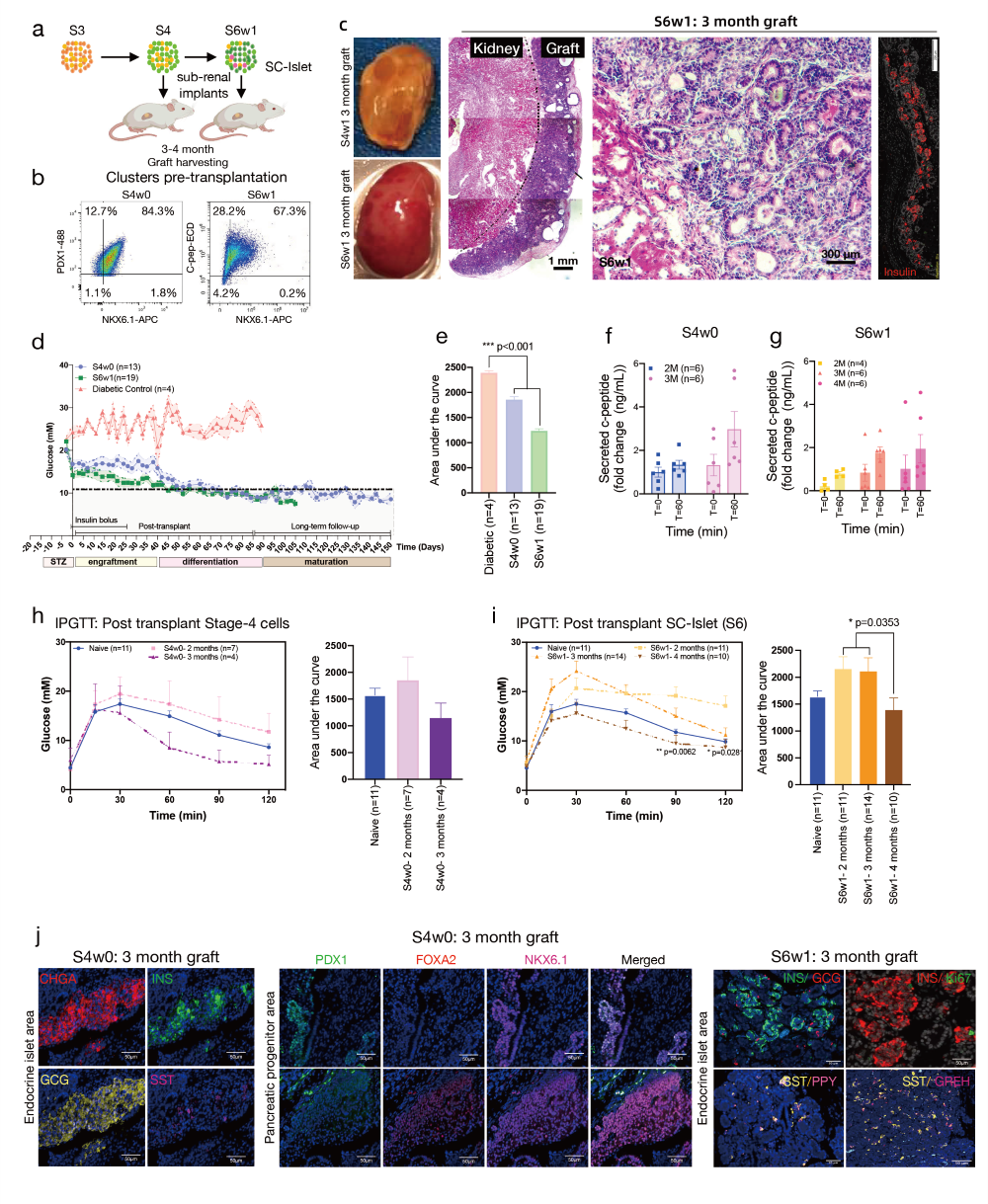
图7. 干细胞衍生的胰腺祖细胞和胰岛簇的体内移植
7、移植物来源的SC-胰岛单细胞显示内分泌谱系优化,转录成熟度与功能活性明显提升
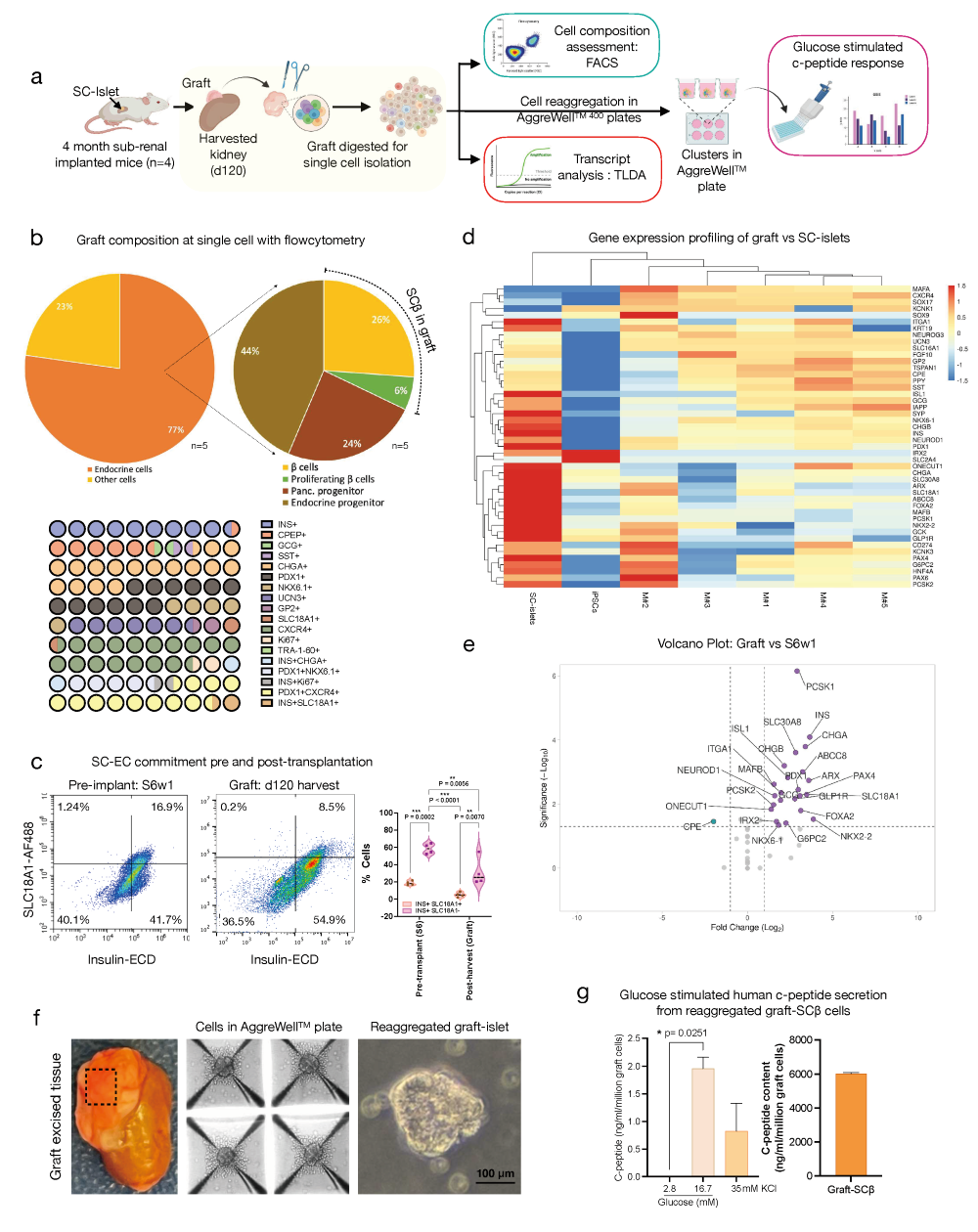
图8. 移植后和成熟期收获的移植物细胞特征:
a. 移植成熟和收获的SC-胰岛细胞的细胞组成、转录组和功能特征的实验概览。
b. 基于流式细胞术的移植物细胞组成的饼图量化和展示,用于分类多种胰腺细胞群体。下方的热图显示了整个移植物细胞组成的部分整体表示。n=4-7只小鼠。
c. 移植前后非靶向SC-EC细胞特征和定量的代表性流式细胞术图。
d. SC-胰岛植入移植物收获组织与移植前S6w1胰岛(3个独立分化准备的平均值)和未分化iPSCs(3个iPSC系的平均值)相比的胰岛分化和成熟基因簇的热图投影。右上角的颜色比例尺表示基因上调(红色;>0)和下调(蓝色;<0)。移植物评估来自n=5只小鼠。SC-胰岛或iPSC数据集表示为n=3个独立复制的平均值。
e. 火山图展示移植后3个月内分泌成熟的程度,与移植前S6w1细胞相比,关键的β细胞、α细胞和内分泌成熟相关基因上调。
f. 移植后3个月收获的肾脏中切除的S6w1移植物图像。在AggreWell400TM板中重新聚集和形成伪胰岛的移植物收获的单分散细胞。重新聚集的移植物衍生的SC-胰岛簇的代表性图像。比例尺为100微米。
g. 体外葡萄糖刺激的人类C肽分泌(左侧)和从一百万移植物收获细胞重新聚集形成胰岛样簇的总人类C肽含量的量化。
四、结论
本研究成功开发了一种生成SC-islets的全阶段完全悬浮分化培养方案。利用垂直轮生物反应器技术使生成iPSC衍生的人类胰岛效率更高。这些胰岛在体外和体内均显示出与成人供体胰岛相似的功能成熟度和转录组特征。垂直轮生物反应器系统不仅提高了胰岛的产量和功能成熟度,还减少了细胞损失和异质性,为未来的糖尿病细胞疗法提供了有力的技术支持。
五、未来展望
这项研究为糖尿病的治疗提供了新的希望。未来的工作将进一步优化这些协议,以实现流体动力学的改进、减少机械剪切应力,并探索去除不需要的非目标细胞群体的方法。最终,这项技术有望加速自体干细胞衍生的胰岛细胞疗法的开发,为所有形式的糖尿病患者提供无需抗排斥药物的治疗方案。
PBS垂直轮式生物反应器的主要特点:
✔ 低剪切、均匀混合的水动力学环境
✔ 0.1L-80L规格,满足客户从早研、临床至商业化生产规模不同阶段的需求
✔ 实现真正可靠的放大性
✔ GMP版本就绪
PBS反应器适用的3D悬浮培养场景(包含但不限于):
➡ iPSC(以聚集体形式生长或基于微载体培养)
➡ iPSC-islets (iPSC分化全流程)
➡ iT/ 原代CAR-T细胞
➡ iNK /原代NK单细胞
➡ 原代 MSC/iMSC
➡ 类器官(iPSC来源神经和心脏类器官等)
➡ 人肿瘤细胞系
上海曼博生物是PBS反应器在国内的官方授权代理商。如想了解更多产品信息、报价、对您项目的适用性等,欢迎联系曼博生物。


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













