
 发布时间:2025/10/15 点击数:538
发布时间:2025/10/15 点击数:538 一、前言
小胶质细胞起源于中胚层和间充质谱系,是中枢神经系统 (CNS) 的主要先天免疫细胞[1]。这些细胞具有高度动态性,能够根据各种神经系统挑战改变其形态和功能。它们在中枢神经系统内的突触可塑性、神经发生、维持体内平衡和免疫防御中发挥着重要作用[2]。小胶质细胞也因其与阿尔茨海默病、帕金森病和肾上腺脑白质营养不良 (ALD) 等神经退行性疾病的关联而日益受到重视[3]。
由于难以从人类供体获取原代细胞,研究人类小胶质细胞一直以来都颇具挑战性。为了克服这一局限性,从诱导多能干细胞 (iPSC) 中获取小胶质细胞已成为一种颇具前景的解决方案。iPSC 是通过将体细胞重编程为多能状态而生成的,可以分化成各种细胞类型,包括小胶质细胞[4]。这种方法为研究小胶质细胞生物学、构建神经系统疾病模型以及探索治疗应用提供了一个便捷、可扩展且用途较广的框架。
将 iPSC 分化为小胶质细胞需要激活关键信号通路,这些通路模拟了卵黄囊祖细胞(yolk sac progenitors)向小胶质细胞的胚胎发育过程。由 IL-34(Qk091)激活的 CSF1R 信号通路对小胶质细胞的存活、增殖和分化至关重要。该受体调节引导祖细胞分化为小胶质细胞谱系的下游过程。TGF-β 通路促进小胶质细胞成熟,并使其获得与其在中枢神经系统 (CNS) 中的作用相关的功能表型。
二、方法
1、细胞培养与维护
每周两次使用0.5 mM EDTA进行iPSC的传代培养,使其脱离细胞。然后,以1:6的传代比例接种于涂有vitronectin(Qk120,浓度5 µg/ml)的6孔板中,并在E8类培养基中培养。传代后的第二天,弃去用过的培养基,换上5 ml新鲜的E8类培养基,从而实现周末无需更换培养基的培养计划。有关此过程的更多信息,请点击参阅我们的指南,了解如何 使用Qkine公司的耐热FGF-2 (bFGF),结合我们不含动物源性的TGF-β1 ( Qk010 )和 vitronectin,进行周末无需更换的人类诱导多能干细胞培养,以提高菌落的均质性。
2、iPSC 分化为小胶质细胞
iPSC接种(第 0 天)
使用 Accutase 分离 iPSC ,并以 3.15×105 个细胞/孔的密度接种于 Matrigel 包被(0.5 mg/ml)的 6 孔板中,培养液为含有 ROCK 抑制剂(Y-27632,10 µM)的 E8 样培养基。
中胚层诱导(第 1-4 天)
对于每个孔,每天用 2 ml 中胚层诱导培养基(表 1)更换培养基,以启动向中胚层谱系的分化。
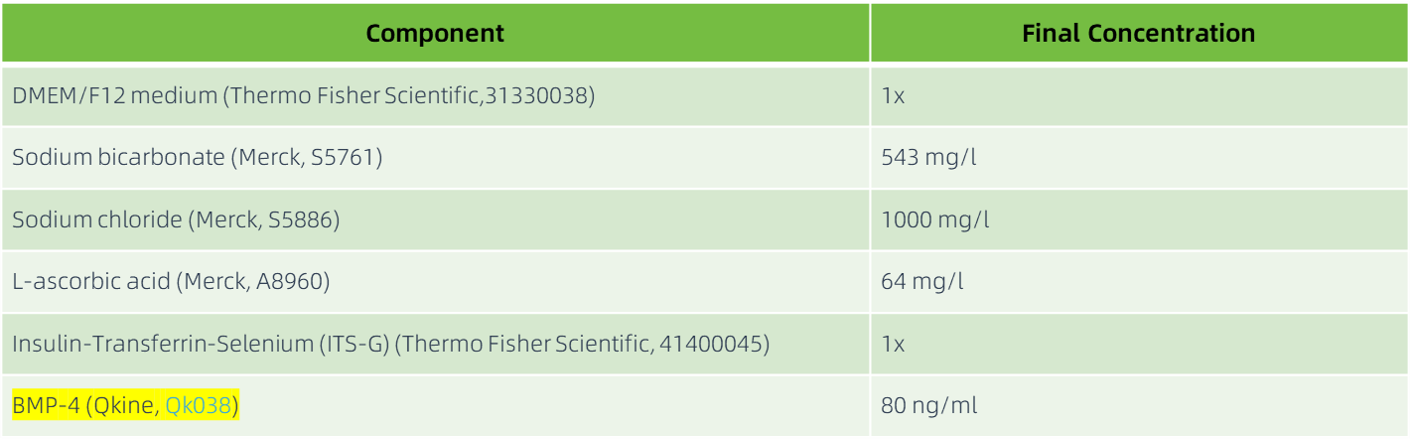
表1:中胚层诱导培养基成分。使用前需无菌添加各组分并进行过滤灭菌。
造血分化阶段(第 5–6 天)
每天更换 2 ml 新鲜的造血分化培养基(见表 2),以促进中胚层细胞向血管母细胞(hemangioblasts)分化。
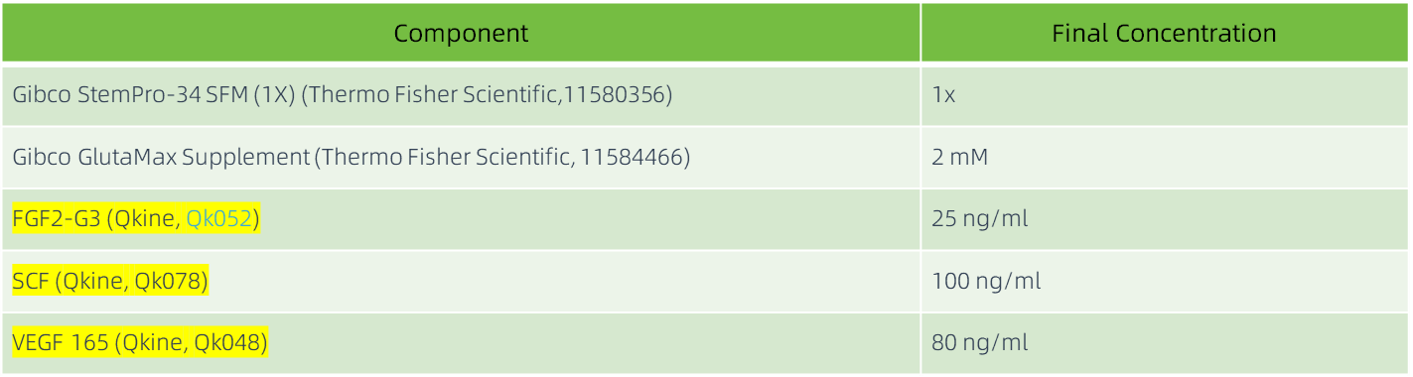
表2:造血分化培养基成分。 所有成分均以无菌方式添加,并在使用前过滤除菌。
髓系祖细胞扩增(第 7-14 天)
每天用 2 ml 新鲜的髓系扩增培养基 (表 3) 更换培养基,以促进分化为髓系祖细胞。
为了保留脱落的成熟细胞,从第10天到第14天,每天收集上清液,以300 xg离心6分钟。离心后,吸出上清液,将细胞沉淀重悬于新鲜培养基中,然后将其放回原孔中。
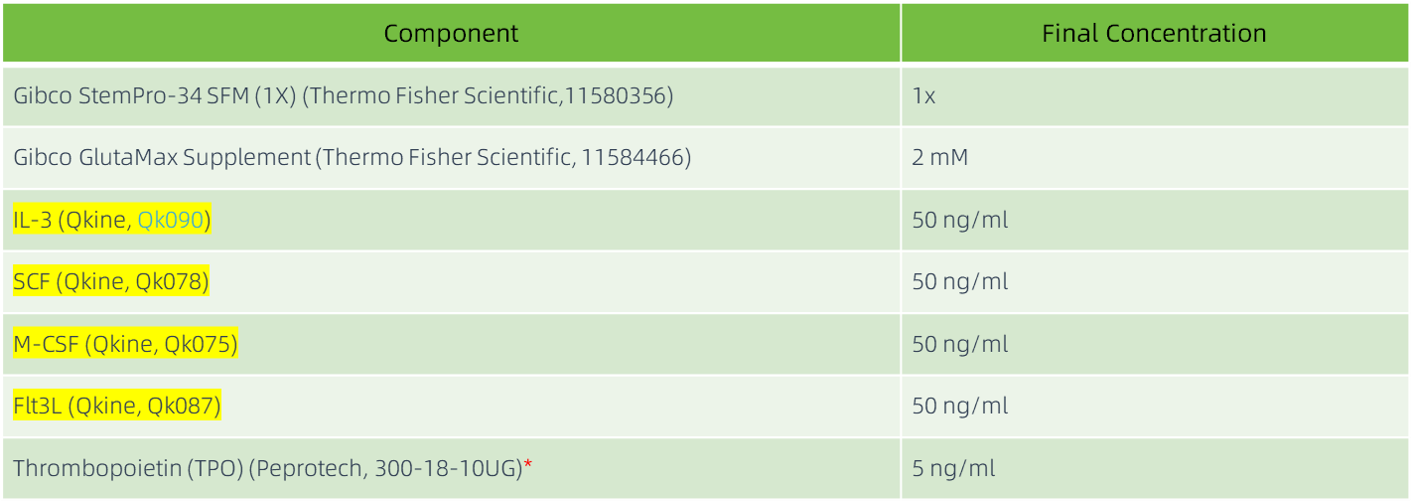
表3:髓系扩增培养基成分。 *根据本应用说明中的数据,Qkine 推出了高纯度、无动物源性的 TPO ( Qk098 ),它为所用的 TPO 提供了合适的替代品。
小胶质细胞祖细胞成熟(第15-25天)
每四天(第15、19和23天)更换一次培养基,加入2 ml小胶质细胞成熟培养基(表4),以促进髓系祖细胞成熟为小胶质细胞祖细胞。每次更换培养基时,收集孔中的上清液,以300 x g离心6分钟。然后吸出上清液,将细胞沉淀重悬于新鲜培养基中,并放回原孔中。

表4:小胶质细胞成熟培养基组成。每个成分均以无菌方式添加,并在使用前过滤除菌。
小胶质细胞祖细胞的分离(第 26 天以上)
收集每孔上清液,300 x g 离心 6 分钟。离心后吸出上清液,将细胞沉淀重悬于适量(约 2 ml)新鲜培养基中并计数。然后将这些细胞以 9.5×105 个/孔的密度接种于基质胶包被(0.5 mg/ml)的 6 孔板中,加入 SF-Microglial 培养基(表 5)。

表5:SF-Microglial培养基组成。无菌添加组分,并在使用前过滤灭菌。
为了促进髓系祖细胞进一步成熟为小胶质细胞祖细胞,可继续在原6孔板中培养,每四天更换一次2 ml小胶质细胞成熟培养基(表4)。培养可持续约50天,在此期间可根据需要进行进一步分离。
分化为成熟小胶质细胞(小胶质细胞祖细胞分离后)
祖细胞在每孔 2 ml SF-Microglial 培养基中分化为小胶质细胞(表 5),两周内每 3 至 4 天更换一次培养基。
3、免疫细胞化学
小胶质细胞用4%多聚甲醛固定,然后用10%驴血清(稀释于0.1% Triton X-100)封闭并透化。使用针对小胶质细胞标志物IBA-1和P2RY12的特异性抗体,在4°C下进行免疫染色过夜。随后清洗细胞,并与二抗( Donkey anti-Goat AlexaFluor 488 或Donkey anti-Rabbit AlexaFluor 488)和Hoechst 33258共同孵育,最后在磷酸盐缓冲液中进行成像。
三、结果
免疫细胞化学分析表明,iPSC衍生细胞获得了小胶质细胞表型。分化后,培养细胞胞体较小,突起细小且高度分支,这与体外小胶质细胞的分枝形态特征一致。标记物染色证实了小胶质细胞特异性蛋白的表达:IBA1标记在整个细胞质中均有检测到,而P2RY12则位于细胞体和细胞膜上,这为小胶质细胞身份提供了清晰的证据(图1和图2)。
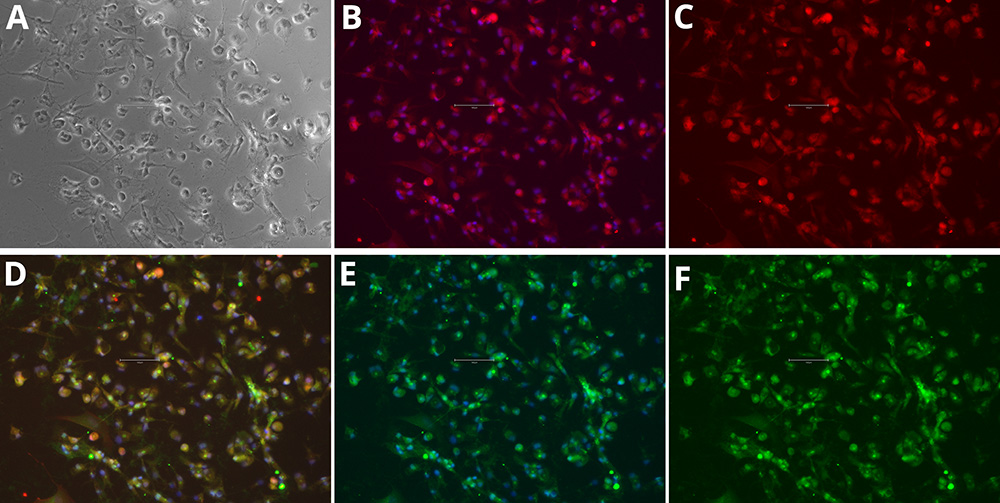
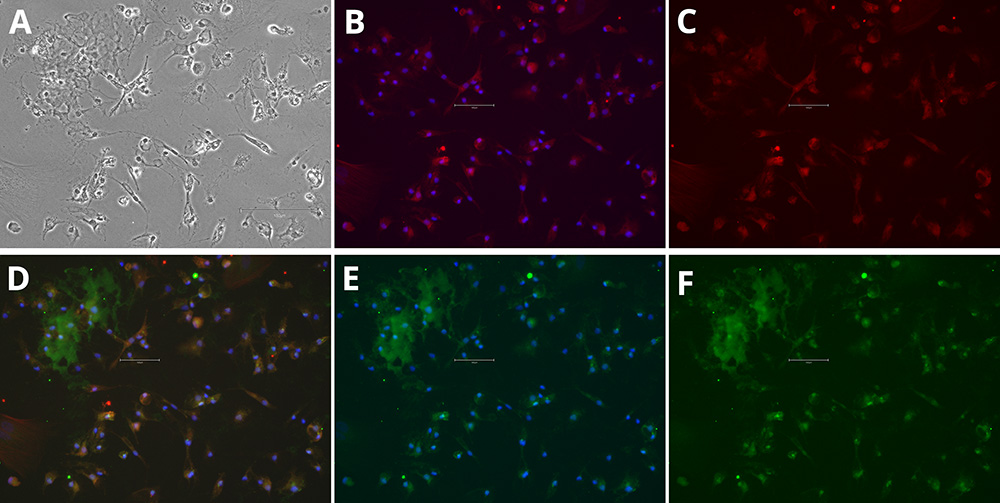
图1-2. 分化 iPSC 中小胶质细胞标志物的免疫细胞化学分析。 Phase Contrast [A], P2RY12 and Hoechst 33258 [B], P2RY12 [Red, C], IBA-1, P2RY12 and Hoechst 33258 [D], IBA-1 and Hoechst 33258 [E], IBA-1 [Green, F]. Images were acquired using the EVOS M5000 system (scale bar = 150 µm).
这些标记物在同一细胞内的共定位进一步支持了其类似小胶质细胞的特征。形态特征和标记物表达模式共同证实了该分化方案能够可靠地产生具有小胶质细胞特征的细胞,适合下游研究。
四、结论
iPSC 在临床和研究应用中的重要性日益凸显,这源于其能够分化成人体各体细胞类型的独特能力。成功分化成特定谱系(例如小胶质细胞)取决于培养过程中维持多能性并实现均质、可重复的分化。使用含有高纯度和生物活性生长因子的优化培养基对于实现效率高、质量高的分化和结果十分重要。
本应用报告提供的数据表明,Qkine 的高纯度、非动物源性生长因子——包括 BMP-4 ( Qk038 )、FGF2-G3 ( Qk052 )、SCF ( Qk078 )、VEGF 165 ( Qk048 )、IL-3 ( Qk090 )、M-CSF ( Qk075 )、Flt3 配体 ( Qk087 )、IL-34 PLUS ( Qk091 ) 和 GM-CSF ( Qk076 )——能够支持 iPSC 稳定可靠地分化为小胶质细胞。这些生长因子降低了差异性并提高了可重复性,这对于研究和治疗应用都非常重要。
分化持续长达50天,每四天更换一次培养基,并在此期间进行额外的细胞分离。通过免疫细胞化学方法确认了成熟的小胶质细胞,其关键标志物IBA1和P2RY12表达。采用无周末培养体系,该体系由耐热FGF-2 ( Qk052 ) 提供支持,并结合无动物源性玻连蛋白 ( Qk120 ) 和TGF-β1 ( Qk010 ),进一步提高了菌落形态的一致性,并降低了操作差异性。
根据本应用说明中的数据,我们推出了一种高纯度、非动物源性的 TPO(Qk098),它为该工艺中之前使用的 TPO 提供了合适的替代品。
这项研究凸显了高质量试剂在克服iPSC分化相关挑战(例如细胞性能不稳定或结果差异)方面的重要性。通过使用Qkine公司提供的一系列成分明确、非动物源性的生长因子,研究人员可以提高复杂、长期细胞培养的可重复性,并推进其在再生医学、药物研发和疾病建模领域的应用。
更多信息
Qkine 生长因子按照高质量标准生产,不含动物源性污染物,具有低内毒性和高纯度。Qkine 致力于提高生长因子、细胞因子和相关蛋白的标准,以更好地支持长期复杂的细胞培养。
上海曼博生物医药科技有限公司是Qkine正式授权的代理商,如有任何疑问或需求,请联系曼博生物。
分化方案是根据 Douvaras P等人(2017 年)[5]描述的方法开发的,我们不主张该文方法的新颖性。
参考文献
[1] Woodburn SC, Bollinger JL and Wohleb ES. The semantics of microglia activation: neuroinflammation, homeostasis, and stress. J Neuroinflammation 18, 258 (2021). https://doi.org/10.1186/s12974-021-02309-6
[2] Abud EM, Ramirez RN, Martinez ES et al. iPSC-Derived Human Microglia-like Cells to Study Neurological Diseases. Neuron. (2017). doi: 10.1016/j.neuron.2017.03.042.
[3] Muffat J, Li Y, Yuan B et al. Efficient derivation of microglia-like cells from human pluripotent stem cells. Nat Med 22 (2016). https://doi.org/10.1038/nm.4189
[4] Chen SW, Hung YS, Fuh JL et al. Efficient conversion of human induced pluripotent stem cells into microglia by defined transcription factors. Stem Cell Reports. (2021). doi: 10.1016/j.stemcr.2021.03.010.
[5] Douvaras P, Sun B, Wang M, et al. Directed Differentiation of Human Pluripotent Stem Cells to Microglia. Stem Cell Reports. (2017) doi: 10.1016/j.stemcr.2017.04.023.


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













