
 发布时间:2025/09/10 点击数:523
发布时间:2025/09/10 点击数:523 一、在先导优化过程中了解药物的生物利用度很重要,因为它直接影响给药策略、治疗效果、安全边际和配方设计
历史上,生物利用度的估算严重依赖于动物实验,这不仅成本高昂,而且往往无法准确预测人体体内的结果。此外,传统方法依赖于孤立的体外试验,而这些试验也往往无法准确预测人体药物的吸收和代谢,这导致了后期代价高昂的失败。对于大型制药公司开发的化合物,在 I 期临床试验中,药代动力学和生物利用度是导致研究失败的第三大原因(占失败总数的16%)( Waring等人,2015 年)[1]。本文探讨了如何将计算机模拟工具与肠道/肝脏芯片(Gut/Liver-on-a-chip)相结合,以提供更准确的生物利用度预测,从而减少对动物实验的依赖。
二、PhysioMimix微流控器官芯片的优势
在CN Bio,我们采用了一种新颖的方法来克服这些局限性,即将原代的人肠道/肝脏微生理系统(MPS,也称为肠道/肝脏芯片)与XianJin的计算模型相结合。这种综合策略弥合了体外测试和体内结果之间的差距,提供了一种更贴近人体的替代方案:
1、提高预测准确性
2、减少对动物研究的依赖
3、提供更省时、更经济的流程
PhysioMimix多器官肠道/肝脏模型独特地允许在单一互联的系统中研究肠道吸收和肝脏清除,这与传统方法中孤立评估这些功能的方式不同。这种互联性模拟了人体生理学,并提供了对生物利用度的整体理解。研究人员普遍担心的是,MPS 是否比传统模型具有已被证实的优势,以及从熟悉的检测方法过渡到器官芯片系统是否过于复杂。这可能是一个艰巨的过渡,但我们会尽力帮助您完成。
CN Bio的内部检测验证和用户使用经验表明,PhysioMimix生物利用度检测试剂盒:Human 18可以轻松顺利地实施。这款一体化生物利用度检测试剂盒包含您的所需,可立即将MPS实验纳入您的流程。然而,我们注意到,在与用户沟通时,他们经常会遇到一些关于如何使用该检测试剂盒及其数据的问题。

此外,监管变革正在加速新方法(NAM) 的采用,例如《FDA 现代化法案 2.0》。FDA 最近宣布决定逐步取消单克隆抗体的动物试验要求[2],并计划将这些变革扩展到其他药物类别,这巩固了多克隆抗体合成 (MPS) 作为现代药物研发流程中一种重要方法的地位。
三、利用计算模型增强 MPS
将计算机模拟工具与器官芯片工作流程相结合,增强了我们对结果的解读,并开启了在下游生理药代动力学 (PBPK) 建模中使用 MPS 产生参数的能力。FDA在其减少临床前安全性研究中动物试验的路线图中强调了PBPK建模日益增长的重要性,并凸显了将实验数据与模拟工具相结合的价值。
机制建模为何重要?
为了促进我们体外检测方法的推广,我们正在开发计算模型,并着眼于商业化。我们的计算模型能够在实验进入湿实验室之前进行计算机模拟。这种预测能力使我们能够优化实验设计,并优化给药浓度、采样时间和其他关键变量,从而使我们的实验人员能够更efficiently获得有意义的结果。PhysioMimix生物利用度检测试剂盒及其计算工具,消除了在设定药物浓度和采样时间点时的不确定性,为每个步骤提供指导。
我们的计算模型基于肠道/肝脏-MPS机制细节,使我们能够从复杂的数据集中提取有意义的ADME参数,其中许多参数难以用传统方法量化。这些参数可用于更好地指导PBPK建模或体外至体内外推 (in vitro to in vivo extrapolation,即IVIVE) 。
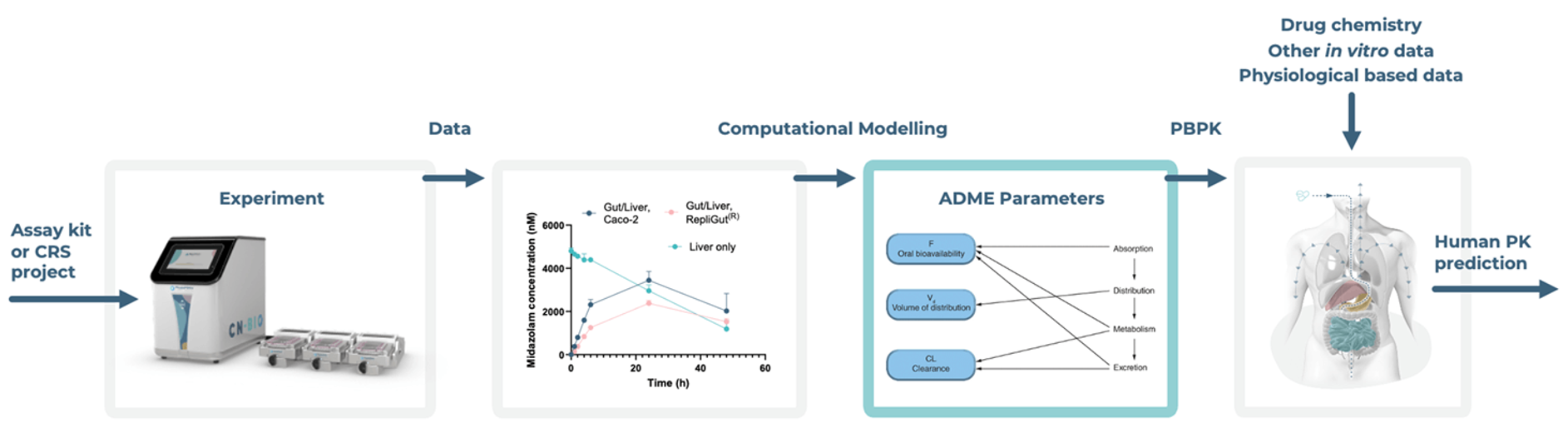
现在,我们可以从每次 MPS 实验的重复实验中识别出多个药代动力学参数,而这些参数通常需要单独进行测定。机制建模也为更深入的生物学洞察打开了大门。它使我们能够解决一些关键问题,例如:“饱和何时发生?”或“系统在什么浓度下会表现出非线性行为?”。
通过将计算机模拟工具与器官芯片技术相结合,我们可以更准确地回答这些问题,而成本仅为同等动物研究的一小部分。
四、将计算机模拟工具与器官芯片集成:咪达唑仑案例研究
在一篇同行评审的论文(Abbas等人,2025)中[3],我们演示了利用器官芯片数据确定咪达唑仑药代动力学参数和生物利用度的工作流程。通过一组实验,我们能够量化 72 小时内咪达唑仑的浓度。数据显示,化合物被吸收,穿过肠膜并进入肝脏,在肝脏中代谢了大部分化合物。
在获得实验数据后,我们建立了数学模型来描述咪达唑仑在MPS中的运动。这一过程使我们能够生成几个具有不同假设的可行模型,这些模型均与实验数据集拟合。然后,我们根据性能标准对每个模型进行排序,并选择性能更佳的模型。利用贝叶斯方法,我们可以确定关键参数的置信区间,例如固有肝脏和肠道清除率(CL int,liver和CL int,gut)、表观通透性(P app)和外排率(Er)。
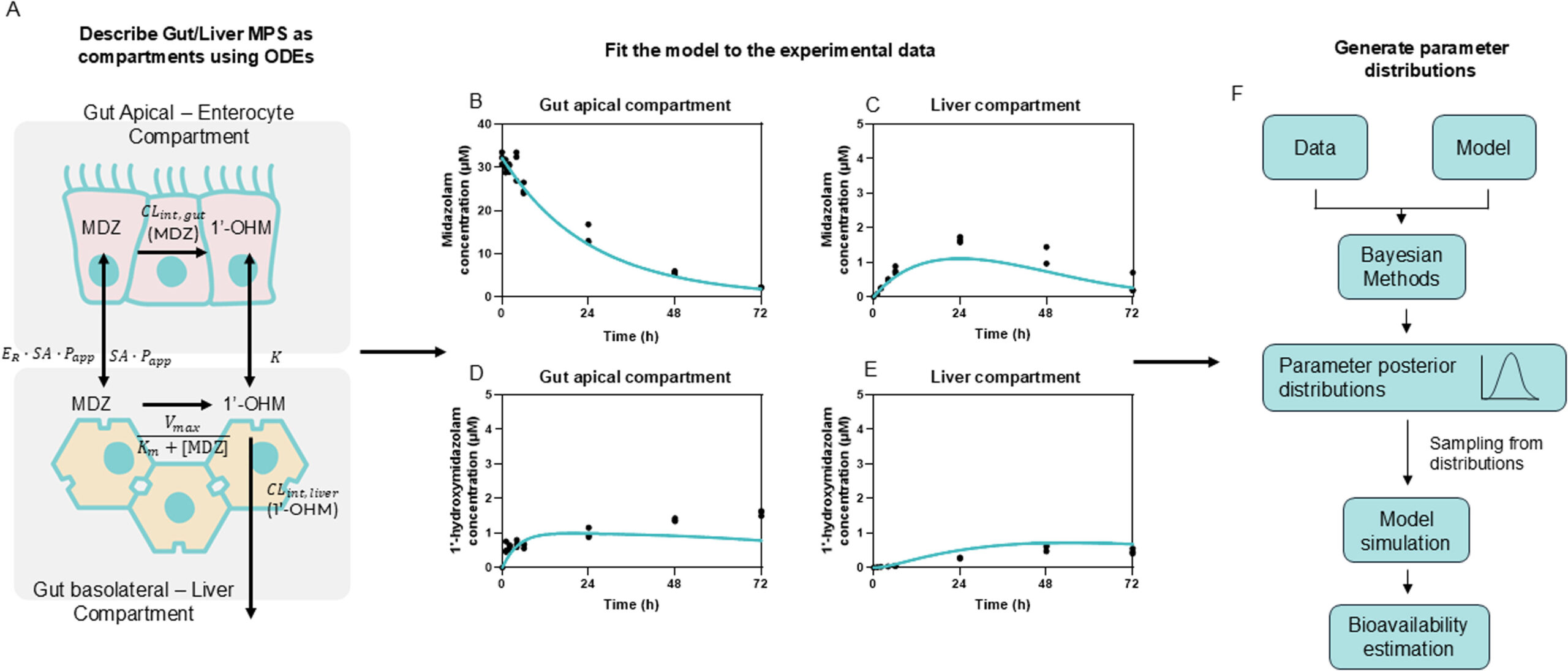
利用模型的输出参数,我们能够计算出生物利用度各组分的值:F a、F g和F h(吸收部分,分别指肠道和肝脏代谢后排出的物质),并通过计算这三个组分的乘积,估算出咪达唑仑的口服生物利用度。我们的预测值在临床观察值范围内。
五、准备开始了吗?
我们估计关键 ADME 参数的方法允许将器官芯片实验用于 PBPK 建模流程,因为可以将所得参数插入到这些更复杂的模型中,从而有可能在人体试验中提供信息。
传统方法获取PBPK建模所需的参数可能耗时、不准确且成本高昂,尤其是在使用动物模型时。将更相关的基于MPS的实验与计算建模相结合,可以提供一种更经济、更易于转化的方法来阐明药物的重要药代动力学参数。该方法的另一个明显优势是进一步减少先导化合物优化过程中的动物实验。
由于实验成本、开展实验所需的内部专业知识以及验证的必要性,人们对于将器官芯片技术应用于工作流程犹豫不决,这已不是什么秘密。然而,随着监管法规即将出台,开启您的 MPS 之旅正当时。我们开发了一套一体化试剂盒[4],其中包含在您的实验室中重现双器官 MPS 和生物利用度分析所需内容,让您轻松上手。
此外,我们还开发了上述计算机模拟工具,并致力于将其商业化。我们的模拟软件可帮助您规划基于MPS的实验,简化工作流程并降低实验成本。第二个工具则帮助您了解如何将使用这种完全人源体外肠道/肝脏模型生成的数据与计算机模拟计算模型相结合 ,以提高PBPK建模输入参数的质量,并更准确地估算口服药物的体内药代动力学参数。Abbas等人在《Drug Metabolism and Disposition 》 (2025)[3]一书中发表了对该工作流程的全面概述。
拓展阅读
CN Bio应用分享 | 评估Caco-2在药物开发ADME金标准的地位
CN Bio:一家经美国FDA验证过的微流控器官芯片系统供应商
曼博生物(MineBio):CN Bio正式授权的中国代理商
作为中国器官芯片领域的专业服务者与资源整合方,曼博生物专注于连接国际前沿技术与本土产业需求,致力于弥补国内器官芯片行业在技术标准化与产业链协同中的短板。通过引入经全球权威机构验证且应用互补的器官芯片技术,我们提供从技术适配、产品供应到场景化应用支持的综合服务,助力中国生物医药企业、科研机构及相关单位探索更优质、更符合伦理的药物研发路径,逐步推动器官芯片在药物开发、有效性评估、毒性评估等领域的实践应用。
参考链接
[1]https://pmc.ncbi.nlm.nih.gov/articles/PMC9293739/
[2]https://cn-bio.com/important-fda-announcement/
[3]https://dmd.aspetjournals.org/article/S0090-9556(25)09139-1/fulltext
[4]https://cn-bio.com/consumables/bioavailability-assay-kit/
[5]https://www.fda.gov/news-events/press-announcements/fda-announces-plan-phase-out-animal-testing-requirement-monoclonal-antibodies-and-other-drugs
[6]https://cn-bio.com/cn-bio-3rsc-project-fda-liver-mps-dili/


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













