
 发布时间:2025/04/16 点击数:810
发布时间:2025/04/16 点击数:810 FDA短讯
告别动物试验,拥抱未来!器官芯片技术推动药物研发新革命
2025年4月10日,FDA宣布逐步取消单抗类药物动物试验要求,承认新兴技术(如类器官、器官芯片、计算机建模等)可能比传统动物试验更能预测人体反应*。(类)器官芯片技术通过高仿人体器官模型,提供更准确、有效的药物测试方案,能够缩短研发周期、降低成本,并减少伦理争议。科学、又效、人道——(类)器官芯片正在重塑医药未来!
寡核苷酸疗法的兴起,用以人为本的方法克服 ADMET 开发挑战
前言、探索未知的奇妙之旅
上一期(点击查看上篇),我们探讨了为什么基于寡核苷酸的疗法越来越受欢迎,它们的 ADMET 发现和开发挑战,以及体外人类 OOC 模型如何通过提供数据丰富的见解来帮助规避这些问题,本期我们将用2个分别与葛兰素史克公司 (GSK) 、阿斯利康(AstraZeneca)合作的器官芯片案例来说明,OOC在该领域的突出益处,从而更好地支持或证明体内非人灵长类(NHP)或人体研究的费用合理性问题。
案例研究 一、以人为本的反义寡核苷酸(ASO)交付和采用
在GSK新发表的一篇论文中,Majer等人[1](2024年)探讨了OOC(器官芯片)技术在解决治疗性ASO(反义寡核苷酸)面临的主要挑战之一——将寡核苷酸以足够浓度递送至目标组织和目标细胞中的潜力。它们的靶向递送对于减少脱靶效应和提高基因沉默的特异性很重要,而这两点对于安全有效的治疗都是必不可少的。
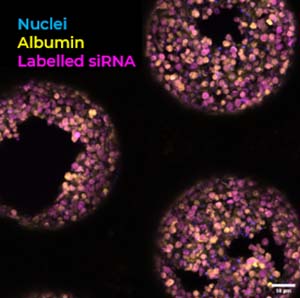
他们的研究通过使用标记/无标记成像技术,利用模型评估了Alexa488(A488)标记的非偶联ASO和GalNAc偶联ASO的细胞摄取和定位情况。(下图)。

图[1]:Liver-on-a-chip 支架的明场成像及单光子荧光显微成像。A)和 B) 分别为 PhysioMimix 肝灌流系统 和 Liver-on-a-chip 支架 的示意图。C) 明场显微图像,展示了 带有孔隙的支架,其中接种了 人原代肝细胞(PHHs)和库普弗细胞(Kupffer cells)。D) 明场显微放大图,清晰呈现 细胞分布于支架表面及其孔隙内部。E)和 F) 代表性 共聚焦单光子激发荧光图像,显示 ASO(反义寡核苷酸)信号在支架表面(左列)和支架孔隙内部(右列,深度 28.5 μm) 的分布情况,分别采用不同放大倍数进行成像。比例尺:D 和 E)200 μm,F)50 μm。
作者提到:“通过在受控的体外环境中复制肝功能的关键方面,如药物代谢、胆汁生成和免疫反应,这些模型为传统的体内动物实验提供了一种成本效益高、稳健且与人类生物学相关的伦理替代方案,可以加速药物的发现和开发。”
该论文提出了一个有趣的观察结果:肝脏芯片缩小了体外实验与体内人类肝脏环境之间的差距,因为模型中的大多数原代人类肝细胞(PHHs)呈立方体形状。研究发现,立方体形状的PHHs在化学成分、形态和ASO分布方面与圆形肝细胞不同,而圆形肝细胞在二维培养中更为常见,但其生理相关性较低。因此,作者排除了圆形肝细胞的数据。这些结果对2D或3D球体模型在此用途上的有效性提出了质疑。
研究观察到[1],在早期时间点,肝脏芯片中的PHHs对非偶联ASO的摄取速度较GalNAc偶联ASO慢,尽管随着时间的推移,非偶联ASO的摄取量更大。这可能是由于GalNAc的高结合亲和力和受体回收不足所致。
案例研究二、解决 ASO 毒性数据差异
与 AstraZeneca 合作的另一项研究利用CN Bio的 PhysioMimix 肝脏芯片来解决动物模型和 2D 肝细胞之间相互冲突的 ASO 毒理学数据。Sewing等人[2](2016 年)在其出版物中引用道:“一系列报告描述了在啮齿动物和非啮齿动物研究中观察到的与 SSO(单链寡核苷酸)诱导毒性相关的变化,但随着更安全的临床前候选药物进入临床,观察到的影响对人类的相关性迄今为止仍不清楚。”
CN Bio 被要求测试两种 ASO,以确定人体系统是否可以提供更多见解。包括丙氨酸氨基转移酶 (ALT) 和 CYP3A4 在内的人类相关标志物能够清楚地显示和预测 ASO-1(有毒)和 ASO-2(安全)之间的人类结果。这让作者进一步清楚了解哪种对人类更安全。
在一项的 CN Bio 研究中,使用仅 PHH 模型,观察到与 Majer 等人[1]的研究类似的结果,即非 GalNAc 结合的 ASO 随着时间的推移对肝细胞的吸收(信号强度)大于 GalNAc 结合的 ASO - 可能是由于 PHH 对 ASO 的处理方式不同。然而,基因敲除数据却讲述了一个不同的故事。这暗示了 ASO 的功效,强调了测量敲除和吸收的重要性。
展望未来,OOC 技术使得各个器官能够连接成系统。随着越来越多的模型可用于流体互连,这些系统可用于探索脱靶效应并可能探索肾脏排泄。
总结
寡核苷酸疗法的兴起代表了治疗复杂疾病的一项重大进展,为传统疗法无法应对的领域提供了靶向且有效的解决方案。尽管潜力巨大,寡核苷酸仍面临独特的挑战,这促使我们需要转向更加以人类为中心的临床前测试方法。
使用人类器官芯片(OOC)模型为许多挑战提供了解决方案。这些模型在受控的体外环境中复制人类器官功能,提供比动物模型更具相关性和预测性的数据。通过提高临床前测试的生理相关性,OOC有助于更好地预测人类反应,为使用昂贵的非人灵长类(NHP)研究提供依据,或在体内模型不适用的情况下提供替代方案,从而加速安全有效的寡核苷酸疗法的开发。
阿斯利康(AstraZeneca)和葛兰素史克(GSK)发表的案例研究突显了OOC模型在解决寡核苷酸开发关键难题中的有效性。这些研究表明,OOC如何为人类特异性反应提供更清晰的见解。
此外,随着OOC技术的不断进步,它有望通过整合多器官系统进一步革新这一领域,从而提供对药物行为和安全性更全面的理解。
总之,采用以人类为中心的方法(如OOC)对于克服寡核苷酸疗法的开发挑战并释放其全部潜力十分重要。
往期推荐
参考资料
[1]https://pubs.rsc.org/en/content/articlelanding/2024/lc/d4lc00504j#
[2]https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0159431
本文由曼博生物翻译编辑整理,原文参考CN Bio官网。上海曼博生物医药科技有限公司是CN Bio正式授权的代理商,想了解更多关于CN Bio PhysioMimix肝脏芯片模型的可能性,联系我们获取更多信息。


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













