
 发布时间:2025/10/30 点击数:335
发布时间:2025/10/30 点击数:335 一、前言
自初次发现以来,人iPSC已彻底改变了生物医学研究,它不仅能够构建患者特异性疾病模型,还能为药物筛选和再生疗法提供可再生细胞来源[1]。维持iPSC处于未分化和遗传稳定的状态,需要能够准确复制必需信号传导环境,同时较大程度减少成分不明确的培养条件。早期依赖于小鼠胚胎成纤维细胞的饲养层依赖型培养系统已基本被无饲养层、化学成分明确的培养基所取代,从而降低了差异性并增强了临床应用性。
1、商业化培养基配方
一些商业化培养基已经得到许多采用:
TeSR-E8 / Essential 8 (E8):仅包含八种特定成分的极简配方,用于在无需血清或饲养层的情况下培养iPSC。这些培养基能够在长时间传代培养中维持多能性标志物的表达、稳定的核型和分化潜能[1]。
NutriStem: NutriStem XF(Sartorius)是一种完全定义的无异种系统,旨在较大限度地减少蛋白质含量,同时保留自我更新的能力[2]。
这些培养基是在现行良好生产规范 (cGMP) 条件下生产的,并经过多条生产线的验证,为学术和临床研究环境提供了可重复性。
2、内部自制配方
学术团体已经开发了开源培养基作为具有成本效益的替代方案。
B8培养基:这种化学成分明确的培养基以优化浓度的胰岛素、转铁蛋白和抗坏血酸替代昂贵的成分,并含有耐热的FGF2变体和TGF-β3。B8支持人类iPSC的长期培养,同时保持核型完整性和多能性标志物的表达[3]。
精细优化(E8 类培养基): Qkine 自主研发的培养基,与 E8 类似,已证明具有相当的维持多能性的能力。这已在描述Weekend-free法培养人诱导多能干细胞的应用说明中得到验证。
虽然内部培养基明显降低了成本,但它们需要严格的质量控制,并且可能在可扩展性、一致性和稳健性方面表现出差异。
本研究旨在直接比较市售iPSC培养基与公司自制配方的性能。评估的关键参数包括细胞形态和增殖率。通过系统地评估这两类培养基,我们旨在为寻求在人类 iPSC 培养系统中平衡成本、性能和实验可重复性的实验室提供实用建议。
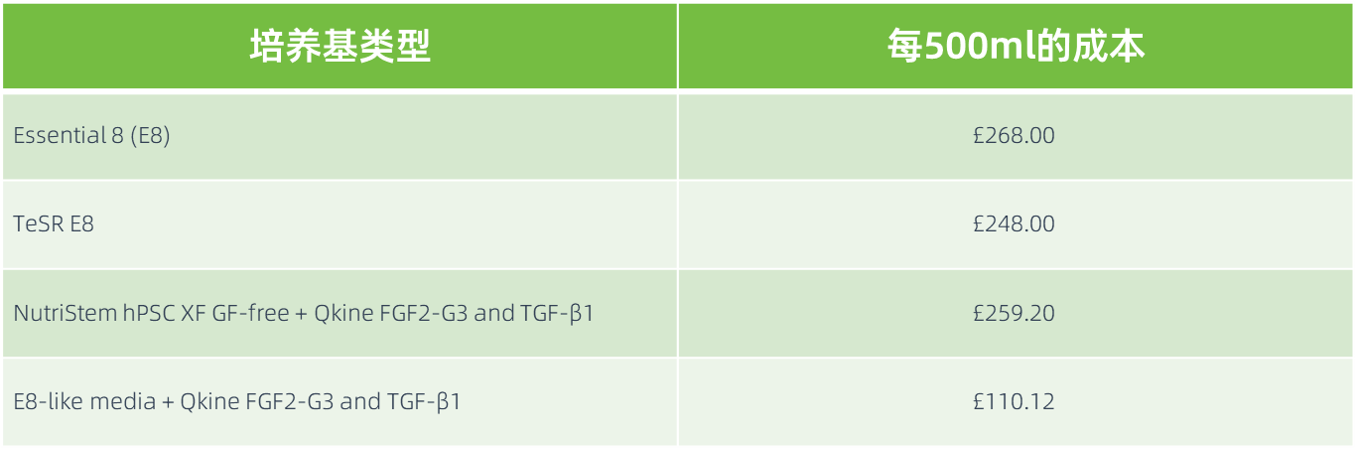
表1:常用 iPSC 培养基每 500 毫升的成本,截至 2025 年 8 月。
二、方法
1、细胞培养与维护
每周两次使用0.5 mM EDTA进行iPSC的传代培养,使其脱离细胞。然后,以1:6的传代比例接种于涂有vitronectin(Qk120,浓度5 µg/ml)的6孔板中,并在E8类培养基中培养。传代后的第二天,弃去用过的培养基,换上5 ml新鲜的E8类培养基,从而实现周末无需更换培养基的培养计划。有关此过程的更多信息,请点击参阅我们的指南,了解如何 使用Qkine公司的耐热FGF-2 (bFGF)(Qk053),结合我们不含动物源性的TGF-β1 ( Qk010 )和 vitronectin ( Qk120 ),进行周末无需更换的人类诱导多能干细胞培养,以提高克隆的均质性。
2、培养基适应
接种后,将 iPSC 转移至测试培养基配方中。在这些条件下培养两周,以便细胞适应,然后进行比较评估。
在 NutriStem 培养基中补充了 Qkine 的 TGF-β1(Qk010)和 FGF2-G3(145aa)(Qk052)以完成培养基配制。
E8 和 TeSR-E8 培养基在整个测试期间每天更换一次。
3、克隆生长试验
适应后的 iPSC 用 0.5 mM EDTA 进行传代,并以 1:6 的比例重新接种到vitronectin包被的 6 孔板(Qk120;5 µg/ml)上,并加入相应的测试培养基。静置 15 分钟后,将培养板置于活细胞成像系统(Axion Omni live-cell imaging system)上,每小时进行一次成像。第二天,将用过的培养基替换为 5 ml 新鲜的 NutriStem和 E8 类培养基,并在整个实验期间持续成像;或者,每天更换 2 ml 新鲜的 E8 和 TeSR-E8 培养基,以确保成像过程不被中断,之后继续每小时进行一次成像。
4、单细胞接种试验
使用 Accutase 分离已适应的 iPSC,并以每孔 1,000 个细胞的密度接种于vitronectin包被的 24 孔板(Qk120;5 µg/ml)。细胞分别在添加了 10 µM ROCK 抑制剂 (Y-27632) 的测试培养基中培养。静置 15 分钟后,将培养板转移至 Axion Omni 成像系统,每小时进行一次成像。第二天,用不含 ROCK 抑制剂的新鲜培养基培养细胞,并根据“克隆生长试验”部分中的说明定时进行,以避免干扰预定的成像过程。
三、结果
自制的E8类培养基配方,添加了Qkine FGF2-G3 (145 aa) 和TGF-β1,能够维持人类iPSC的水平,与市售的TeSR-E8和E8培养基相当。在自制的TeSR-E8和E8培养基中观察到典型的未分化集落形态(图1和图2)。iPSC在6孔板(图3)和24孔板(图4)上的增殖率也相似,使用Axion Omi系统进行验证。在E8类培养基中培养的细胞与在TeSR-E8或Essential 8培养基中培养的细胞在生长动力学和集落完整性方面没有明显差异。
在 NutriStem 培养基中,最初未观察到典型的致密集落形态(图1和图2,C 和 F)。这些集落最初会扩展成尖刺状,然后压缩并恢复到更常见的致密形态和圆形集落。这些在 NutriStem 中形成尖刺状集落的较大细胞在定量分析中最初在该培养基中增殖率较高(图3 和图4),但随着集落逐渐圆润,最终趋于平稳。这些结果表明,Qkine FGF2-G3/TGF-β1 制剂为 iPSC 培养提供了一个有效、成分明确且无异源物的系统。
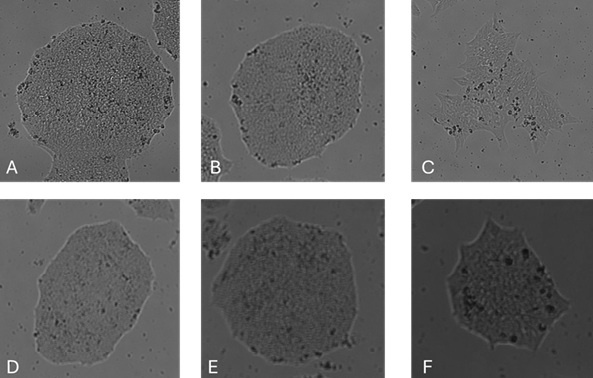
图1
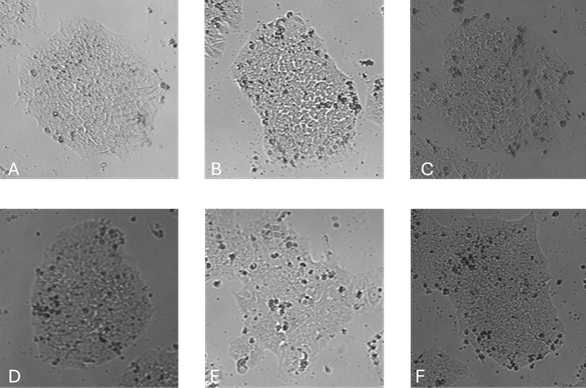
图2
图1-传代 48 小时后的克隆形态和 图2-单细胞传代 48 小时后的克隆形态:在以下培养基中培养的 iPSC 的代表性图像:(A) 含 FGF2-G3 (145 aa) 的 E8 样培养基 ( Qk052 );(B) 含 FGF2-G3 (154 aa) 的 E8 样培养基 ( Qk053 );(C) 含 FGF2-G3 (145 aa) 的 NutriStem ( Qk052 );(D) Life Technologies E8;(E) TeSR-E8;(F) 含 FGF2-G3 (154 aa) 的 NutriStem ( Qk053 )。图像是使用 Axion Omni 活细胞成像系统获取的。除NutriStem外,在所有条件下均观察到典型的紧凑克隆形态,在NutriStem中,克隆最初扩展为尖刺形态,然后恢复为更小、更紧密、更圆形的克隆。

图3:基于 6 孔板孔覆盖率的生长率分析(重复测量三次)。使用 Axion Omni 活细胞成像系统评估生长率。NutriStem 培养基观察到生长率增加,这归因于克隆向外扩展以占据可用的孔空间,然后形成紧密堆积的克隆。
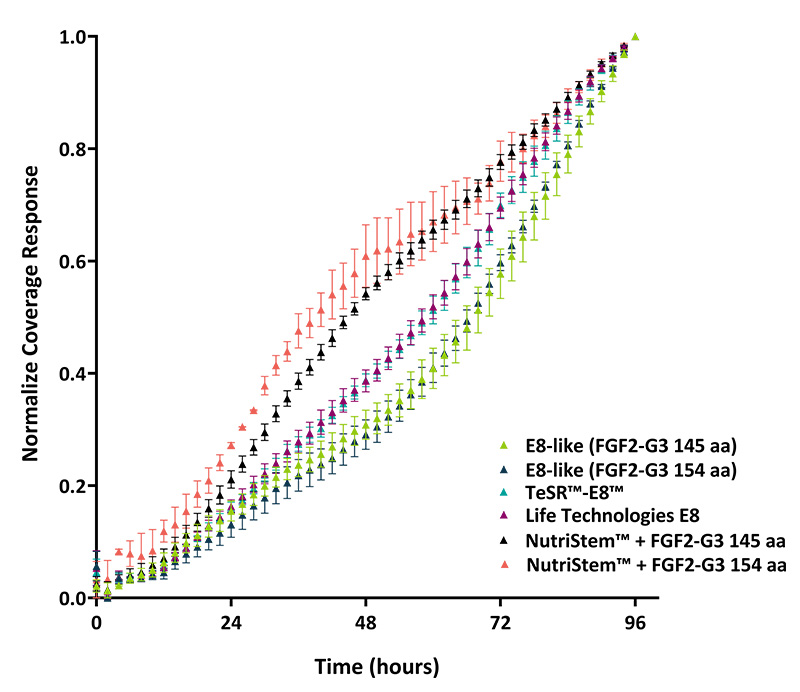
图4:基于 24 孔板孔覆盖率的生长率分析(重复测量三次)。使用 Axion Omni 活细胞成像系统评估生长率。NutriStem 培养基观察到生长率增加,这归因于克隆向外扩展以占据可用的孔空间,然后形成紧密堆积的克隆。
四、结论
在本研究中,我们评估了多种用于维持人类诱导多能干细胞 (iPSC) 的培养基。结果表明,一种类似 E8 的配方,其包含 Qkine TGF-β1 ( Qk010 ) 和耐热 FGF-2 (bFGF)( Qk052 或 Qk053 ),能够支持 iPSC 维持,其水平与不含异源物、化学成分明确的 TeSR-E8 和 Essential 8 (E8) 培养基相当。当与重组人vitronectin ( Qk120 )结合使用时,该培养基可维持 iPSC 的增殖率和典型的集落形态。
本文提出的特定条件可增强 iPSC 培养的实验可重复性和一致性,无论是在基础研究还是转化研究中。此外,该条件能够在不影响安全性或功能性的情况下维持 iPSC 的长期培养,为大规模扩增提供了一种经济有效的策略,从而促进较广的下游应用。
这些 iPSC 随后分化为各种胚层和细胞类型,进一步表明使用我们的周末免培养基更换条件与生长因子相结合可以维持它们的多能性。
与在 “E8 型”培养基中培养的 iPSC 相比,那些细胞虽然表现出相似的增殖速率,但自发分化水平更高,从而降低了 iPSC 集落在后续研究中的质量。此外,细胞需要每天更换培养基,导致维持培养的成本和时间投入更高(数据可根据要求提供)。
Qkine 生长因子按照zui高质量标准生产,不含动物源性污染物,具有低内毒性和高纯度。Qkine 致力于提高生长因子、细胞因子和相关蛋白的标准,以更好地支持长期复杂的干细胞培养。
Qkine是一个以科学为主导的团队,上海曼博生物医药科技有限公司是Qkine正式授权的代理商,如有任何疑问或需求,请联系曼博生物。
参考文献
[1] Chen G, Gulbranson DR, Hou Z, et al. Chemically defined conditions for human iPSC culture: the Essential 8 medium. Nat Methods. 2011;8(5):424-429. doi: 10.1038/nmeth.1593
[2] Lim JJ, et al. Defined, xeno-free media for human pluripotent stem cell culture: a comparative analysis. Stem Cell Res Ther. 2019;10:52. doi: 10.1007/978-1-61779-201-4_9
[3] Lyra-Leite DM, et al. B8 medium: a chemically defined, cost-efficient formulation for human iPSC maintenance. Stem Cell Reports. 2020;14:1-12. doi: 10.1002/cpsc.110


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白 













