发布时间:2026/01/16 点击数:128
发布时间:2026/01/16 点击数:128 注:全文9694字,预计阅读时间25分钟,如需原文资源可联系上海曼博生物。
本文概况
了解CN Bio的PhysioMimix微流控器官芯片系统如何提供肝脏MPS DILI检测,从而促进在人类、大鼠和犬模型中进行体外肝毒性测试,并增强您在临床前预测药物性肝损伤风险的能力。
您将获得:一份实用且数据丰富的总结,概述了PhysioMimix人类、大鼠和犬肝细胞微组织的培养、鉴定和用于预测体内安全性概况的方法——包括检测时间表、终点(LDH、ALT、尿素、白蛋白)以及与已建立的DILI等级的跨物种比较。上海曼博生物可提供器官芯片/类器官相关技术支持,如有需要欢迎咨询。
5个跨物种药物性肝损伤检测的关键要点:
有活性且具有功能性的人类和动物肝脏MPS可持续长达14天
预测胆汁酸和线粒体功能障碍
深入揭示物种间差异的机制,有助于减少药物毒性误判或错误分类(misclassification)
增强对MPS的信心,从而优化非临床研究中的动物物种选择、减少不必要的动物使用,并更准确地预测人体反应
一种稳健且快速的方法,用于评估存在冲突的动物安全性研究数据,以判断哪种动物模型的结果最贴近相应的人体结局
一、引言
药物性肝损伤(Drug-Induced Liver Injury, DILI)是药物研发中面临的一项重大挑战,也是全球范围内导致急性肝衰竭(Acute Liver Failure, ALF)的主要原因之一。DILI 在临床试验后期失败、上市后撤市以及药物发现阶段化合物淘汰中占据了相当大的比例¹。因此,采用能够提供与人类相关数据并揭示毒性机制的体外模型,已成为药企的战略重点。
近期监管环境发生明显转变——尤其是美国食品药品监督管理局(FDA)和英国政府相继发布路线图,旨在通过增加对新方法学(New Approach Methodologies, NAMs)的应用来减少动物实验——这进一步强化了对更具可转化性和复杂性的模型的需求,以更准确地预测体内研究结果及人体反应²。
传统的非临床模型在预测与人类相关的肝毒性方面往往存在不足。尽管动物模型可在一定程度上预示药物在临床研究中的毒性结果,但人类、啮齿类动物和犬类在生物学上的明显差异仍是难以逾越的障碍。例如,某些药物在动物研究中被错误地标记为DILI阳性,从而导致可能具有变革性疗效的疗法无法惠及患者;反之,一些在动物中被认为安全的药物却在人体中表现出严重肝毒性。这一问题已通过多起上市后因患者出现肝损伤症状而被迫召回药物的案例得到印证,其中曲格列酮(troglitazone)便是一个广为人知的例子³。
鉴于这种公认的可转化性缺陷,FDA与IQ微生理系统(MPS)联盟已建议开发基于动物的肝脏模型,以弥合现有差距,并增强对NAMs预测能力的信心²。
此前,我们已证明PhysioMimix人源DILI检测在评估工具化合物安全性排序及绘制不良结局通路(Adverse Outcome Pathways)方面的实用性与预测能力⁴。在此,我们进一步展示了PhysioMimix系统的适应性:该系统可在Liver-12+微孔板(货号:MPS-LC12)中成功培养并维持原代大鼠和犬肝细胞,形成微组织并稳定维持长达14天。此外,我们选取三组工具化合物应用于这些非临床动物模型,以评估其模拟和预测相应物种体内安全性特征的能力。
二、研究目标
1.证明可在 PhysioMimix Liver-12+ 微孔板中培养具有功能活性的大鼠和犬原代肝细胞,并维持长达14天的培养。
2.证明基于大鼠和犬肝脏构建的微生理系统(Microphysiological System, MPS)能够针对一组涵盖从重度到轻度肝毒性的六对化合物,生成与体内相关、高内涵的数据(包括七个终点指标的IC:50剂量–反应曲线)。
三、材料与方法
1.原代细胞培养与药物处理
本实验采用PhysioMimix跨物种DILI检测方法进行。冻存的大鼠或犬原代肝细胞购自Primacyt或BioIVT公司。细胞使用动物肝脏接种培养基(Animal Liver Seeding Media)接种至PhysioMimix多芯片Liver-12+(MPS-LC12)微孔板中。随后,按照标准的动物DILI检测方案,将细胞置于PhysioMimix核心系统中,在动物肝脏维持培养基(Animal Liver Maintenance Media)中培养8天。
在培养第4天,对肝微组织的功能性和组织健康状况进行质控评估(检测指标包括乳酸脱氢酶LDH、尿素和白蛋白)。随后,对肝MPS微组织施加测试化合物,每种化合物设置七个浓度梯度,每日给药一次,连续给药4天。溶剂对照组为0.3% DMSO。处理组与未处理对照组在Multi-chip Liver-12+板上随机分布,每种实验条件均设3个重复。
2.肝微组织的功能评估
在接种后第4天,通过采集培养上清液对肝 MPS 微组织进行质控检测。
细胞毒性通过Cytotox 96非放射性细胞毒性检测试剂盒(Promega,货号 G1780)测定LDH释放量,分别在给药前后进行评估;
尿素释放量采用QuantiChrom尿素检测试剂盒(BioAssay Systems,货号 DIUR-100)进行测定;
白蛋白表达水平则分别使用犬白蛋白ELISA试剂盒(Abcam,货号 ab277078)或大鼠白蛋白ELISA试剂盒(Abcam,货号 ab235642)进行定量。
各指标均在培养第4、6和8天按供应商说明书进行检测。
3.数据分析
统计分析及图表绘制使用 GraphPad Prism 10 软件完成。数据以每次实验的均值 ± 标准差(SD)表示。统计学分析采用单因素方差分析(one-way ANOVA on ranks)。显著性水平定义如下:* 表示 P < 0.05;** 表示 P < 0.01;*** 表示 P < 0.001;**** 表示 P < 0.0001(采用范围检验法)。
四、结果
1.PhysioMimix微流控器官芯片系统支持构建3D动物肝脏微组织。
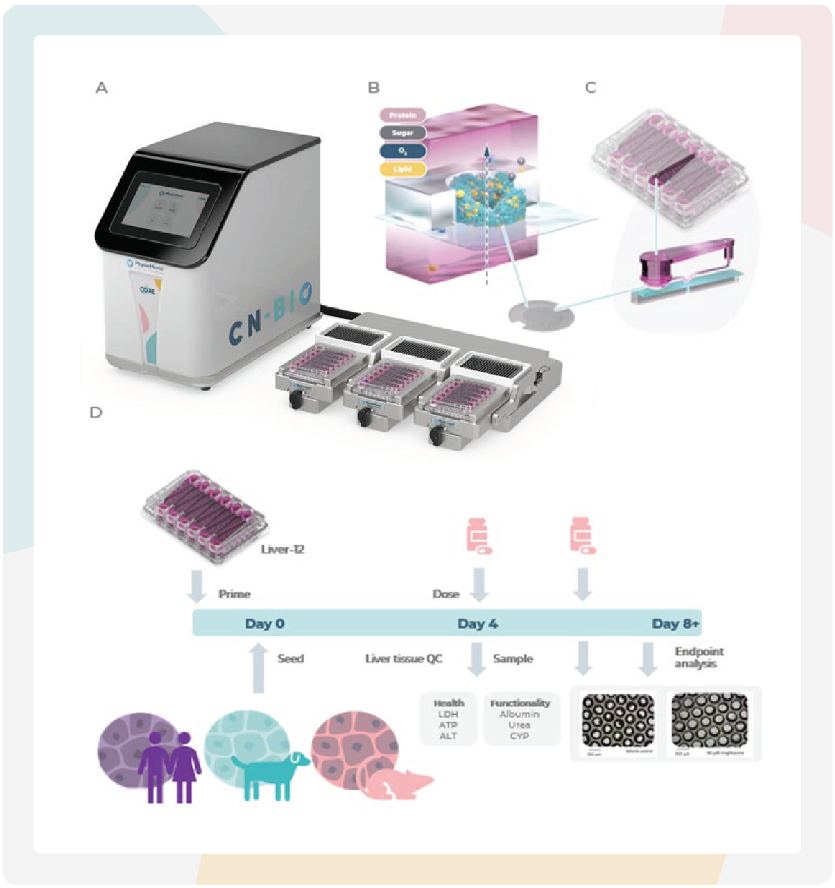
图1:PhysioMimix微流控器官芯片系统支持构建3D动物肝脏微组织。
A) PhysioMimix微生理系统硬件组成,包括控制器(Controller)、对接站(Docking Station)和单器官驱动模块(Single-Organ Drivers)。
B) 微孔横截面示意图,展示通过微型泵实现灌注流动,使3D肝微组织在支架上获得持续的流体供应。
C) PhysioMimix Multi-chip Liver-12+微孔板示意图,其采用开放式孔设计,可在工程化支架上以3D形式培养原代人、大鼠或犬肝细胞。
D) 标准跨物种DILI检测的实验时间线。通过在肝脏MPS中培养原代大鼠或犬肝细胞构建微组织,用于评估药物性肝损伤(DILI)。图中展示了代表性显微照片。
2.利用PhysioMimix微流控器官芯片系统及优化培养基,大鼠和犬肝细胞可维持活力与功能长达14天。
在接种后第4天,通过采集培养上清液对肝 MPS 微组织进行质控检测。
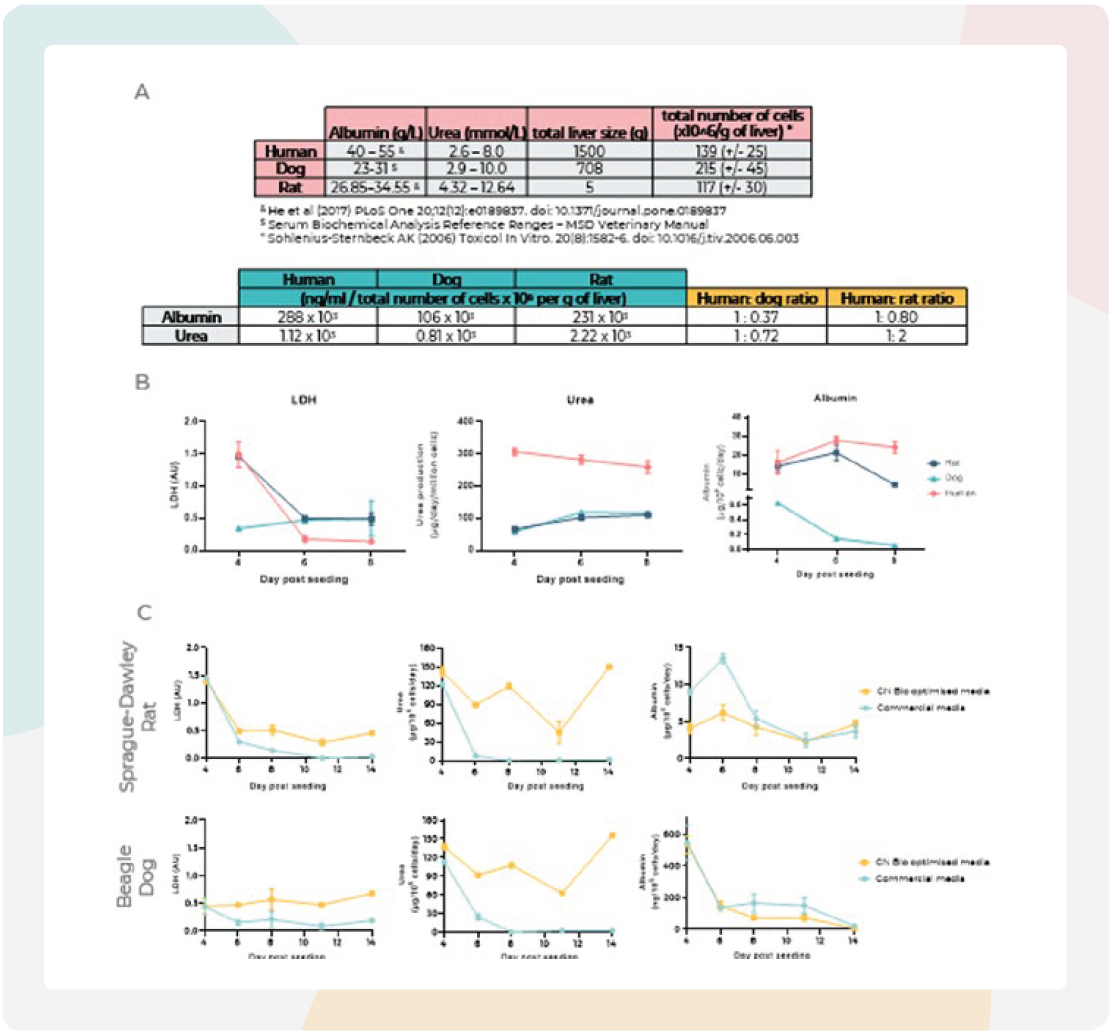
图2:利用PhysioMimix微流控器官芯片系统及优化培养基,大鼠和犬肝细胞可维持活力与功能长达14天。
A) 表1:文献报道的人、犬和大鼠血液中白蛋白与尿素的平均浓度,以及肝脏总质量与每克肝组织中的细胞数量;表2:基于每克肝脏中平均细胞数量,计算得出的大鼠、犬和人肝脏白蛋白与尿素的理论产量。
B) 在PhysioMimix Multi-chip Liver-12+微孔板中,人、大鼠和犬肝细胞在8天培养期间的LDH(乳酸脱氢酶)、尿素和白蛋白水平变化。
C) CNBio优化培养基与市售商业培养基的对比:在PhysioMimixMulti-chip Liver-12+微孔板中,使用大鼠和犬肝细胞培养14天期间,关键生物标志物(如白蛋白和尿素)的变化趋势比较。
3.大鼠MPS通过白蛋白减少和ALT升高预测曲格列酮的肝毒性。
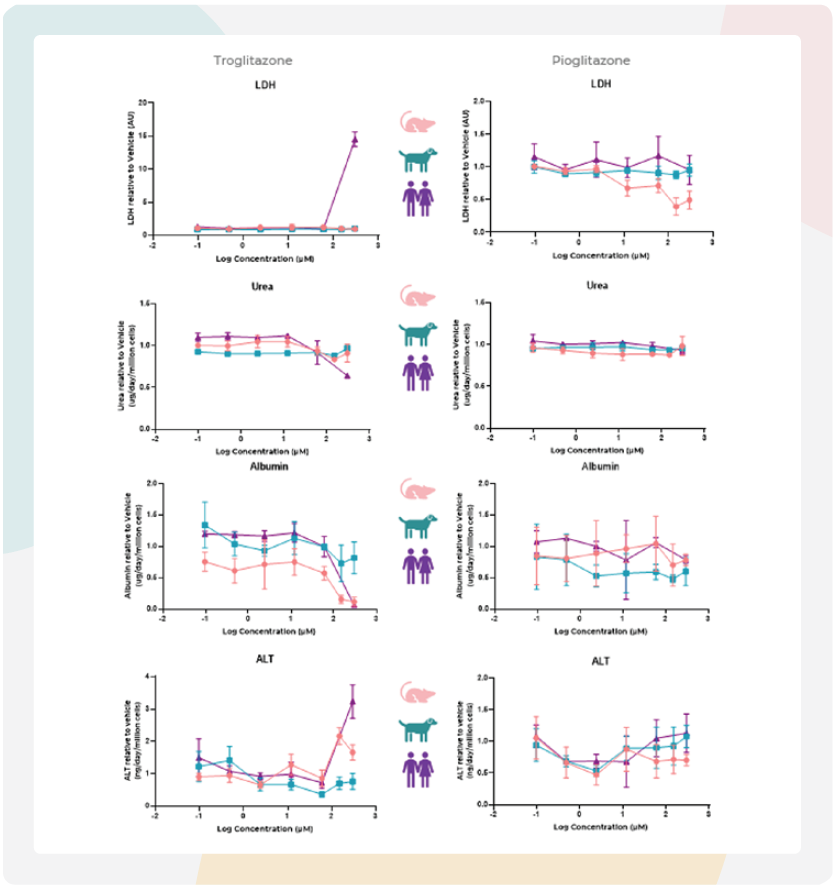
图3:大鼠MPS通过白蛋白减少和ALT升高预测曲格列酮的肝毒性。
使用原代大鼠(左)和犬(右)肝细胞构建的肝脏MPS模型,对高DILI风险药物曲格列酮(粉色)与低DILI风险药物吡格列酮(蓝色)进行DILI特征评估,检测指标包括细胞活力(LDH、ALT)和肝功能(尿素、白蛋白)。
肝脏微组织在MPS中暴露于曲格列酮或吡格列酮96小时。所有终点数据均来自同一批肝脏MPS培养物。
图中数据为均值±标准差(SD),n=3,各样本均采集自给药后48小时。
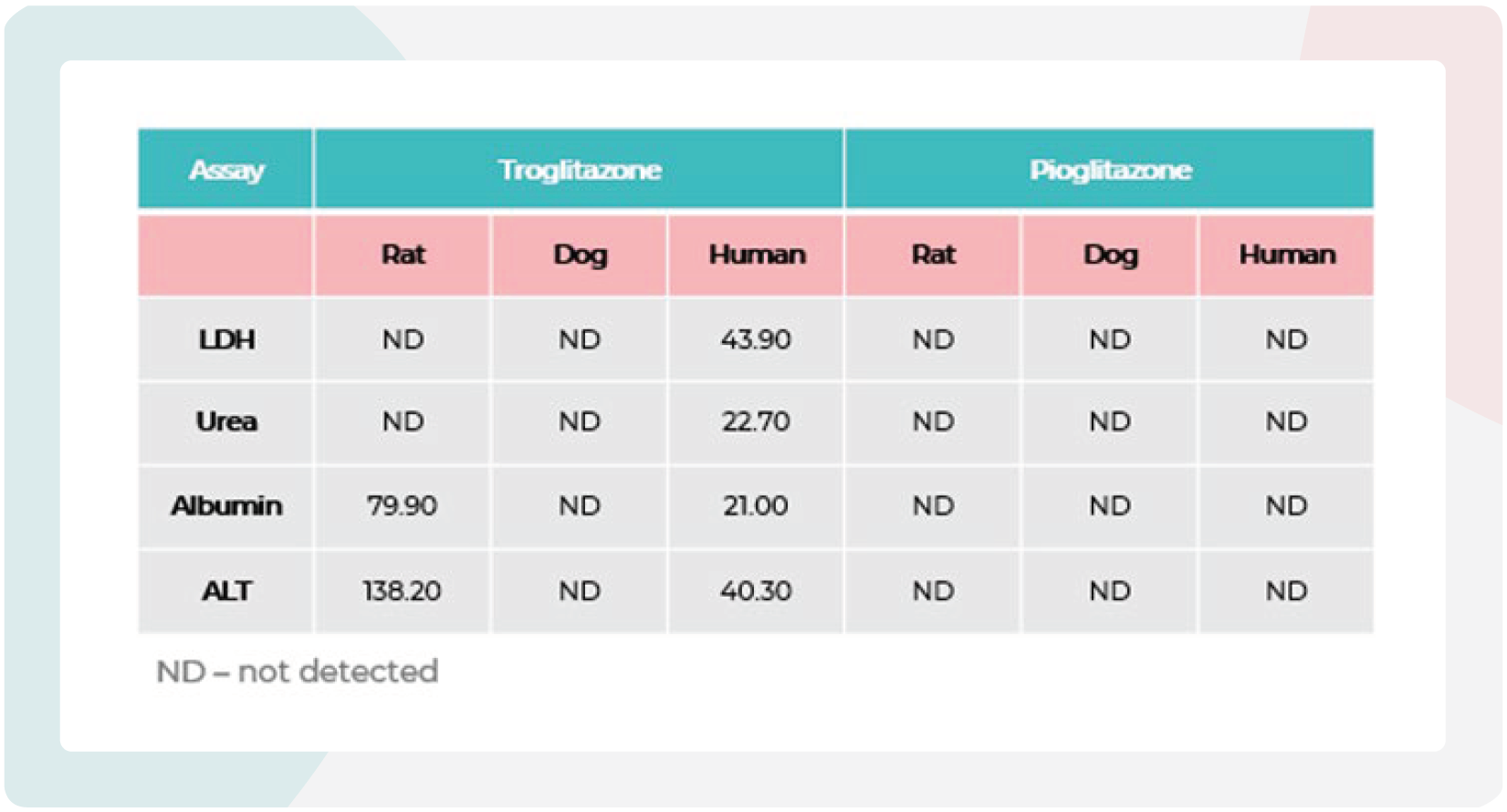
表1:曲格列酮(troglitazone)与吡格列酮(pioglitazone)在大鼠、犬和人肝脏MPS微组织中的IC:50值。
跨物种肝脏微组织在MPS中暴露于曲格列酮和吡格列酮96小时。数据来源于七点浓度梯度的剂量–反应曲线,每个浓度设三个重复(N=3)。曲格列酮和吡格列酮的最高测试浓度均为300µM。
4. 大鼠MPS通过白蛋白水平下降预测奈法唑酮的肝毒性风险。
在接种后第4天,通过采集培养上清液对肝 MPS 微组织进行质控检测。
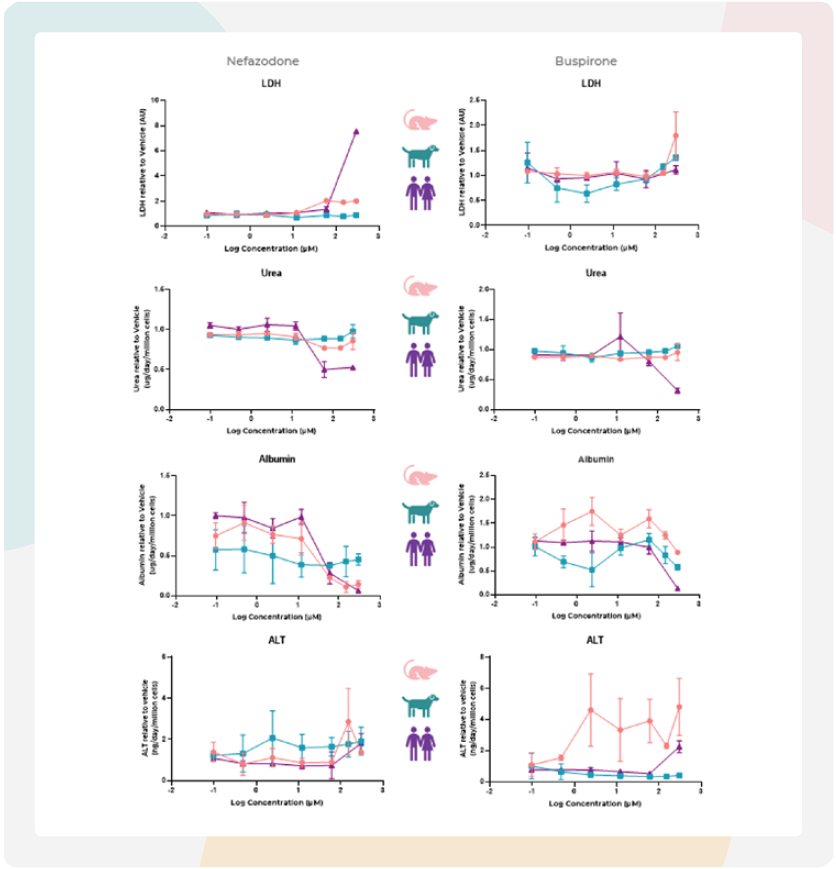
图4:大鼠MPS通过白蛋白水平下降预测奈法唑酮的肝毒性风险。
使用原代大鼠(左)和犬(右)肝细胞构建的肝脏MPS模型,对高DILI风险药物奈法唑酮(粉色)与低DILI风险药物丁螺环酮(蓝色)进行DILI特征评估,检测指标包括细胞活力(LDH、ALT)和肝功能(尿素、白蛋白)。肝脏微组织在MPS中暴露于奈法唑酮或丁螺环酮96小时。所有终点数据均来自同一批肝脏MPS培养物。
图中数据为均值±标准差(SD),n=3,所有样本均采集自给药后48小时。
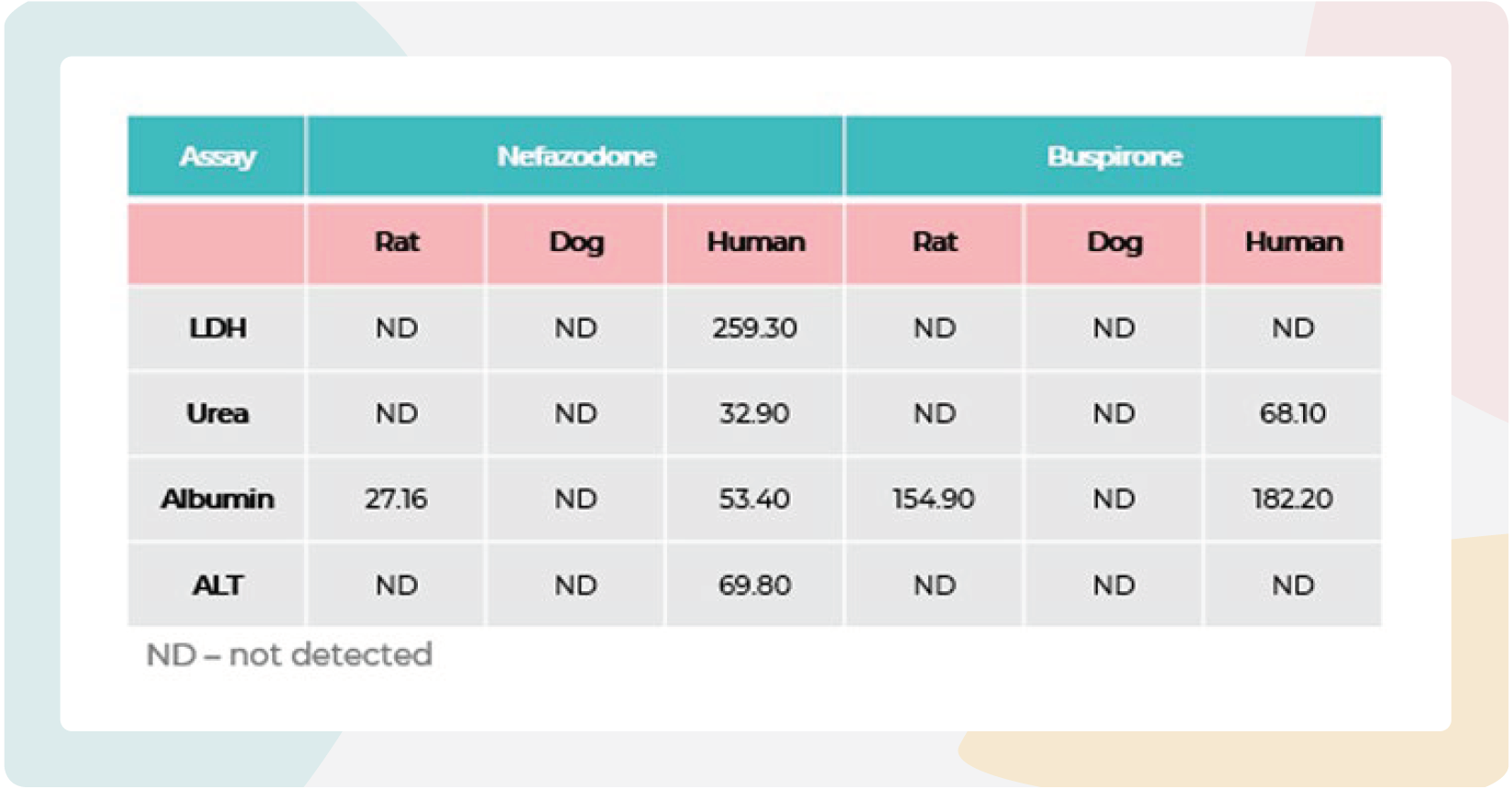
表2:奈法唑酮(nefazodone)和丁螺环酮(buspirone)在3D大鼠、犬和人肝脏MPS微组织中的毒性。
奈法唑酮(nefazodone)和丁螺环酮(buspirone)在3D大鼠、犬和人肝脏MPS微组织中的毒性。动物源肝脏微组织在MPS中暴露于奈法唑酮和丁螺环酮96小时。数据来源于七点浓度梯度的剂量–反应曲线,每个浓度设三个重复(N=3)。奈法唑酮与丁螺环酮的最高测试浓度均为300µM。
5.大鼠和犬MPS均能通过白蛋白、LDH和ALT的变化预测托卡朋的肝毒性。
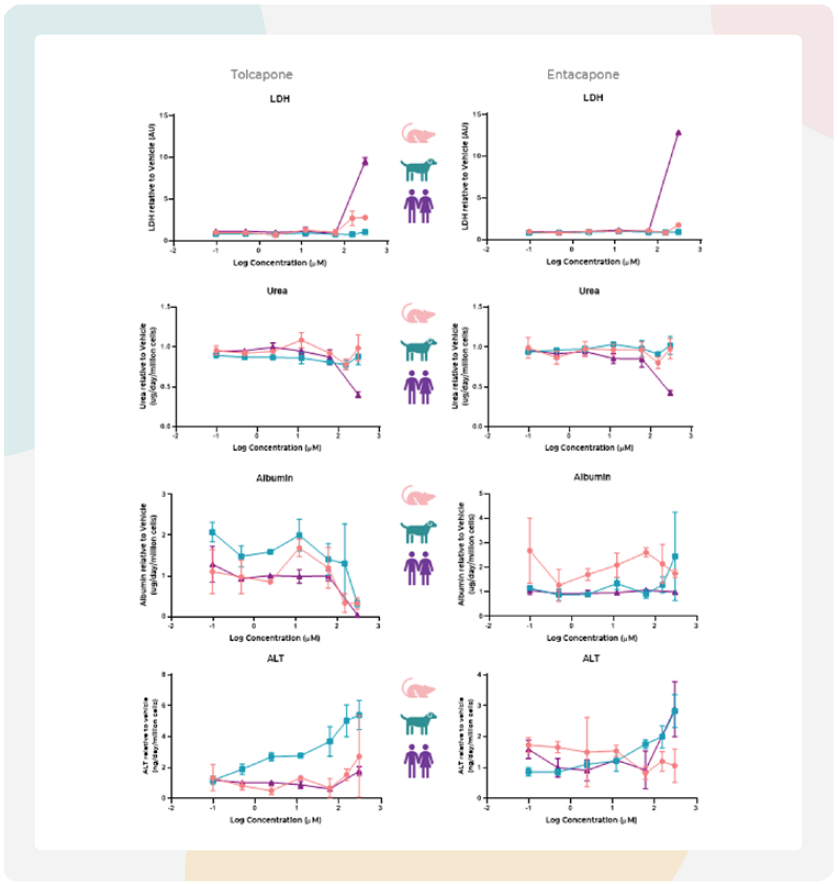
图5:大鼠和犬MPS均能通过白蛋白、LDH和ALT的变化预测托卡朋的肝毒性。
使用原代大鼠(左)和犬(右)肝细胞构建的肝脏MPS模型,对高DILI风险药物托卡朋(粉色)与低DILI风险药物恩他卡朋(蓝色)进行DILI特征评估,检测指标包括细胞活力(LDH、ALT)和肝功能(尿素、白蛋白)。肝脏微组织在MPS中暴露于托卡朋或恩他卡朋96小时。所有终点数据均来自同一批肝脏MPS培养物。图中数据为均值±标准差(SD),n=3,各样本均采集自给药后48小时。
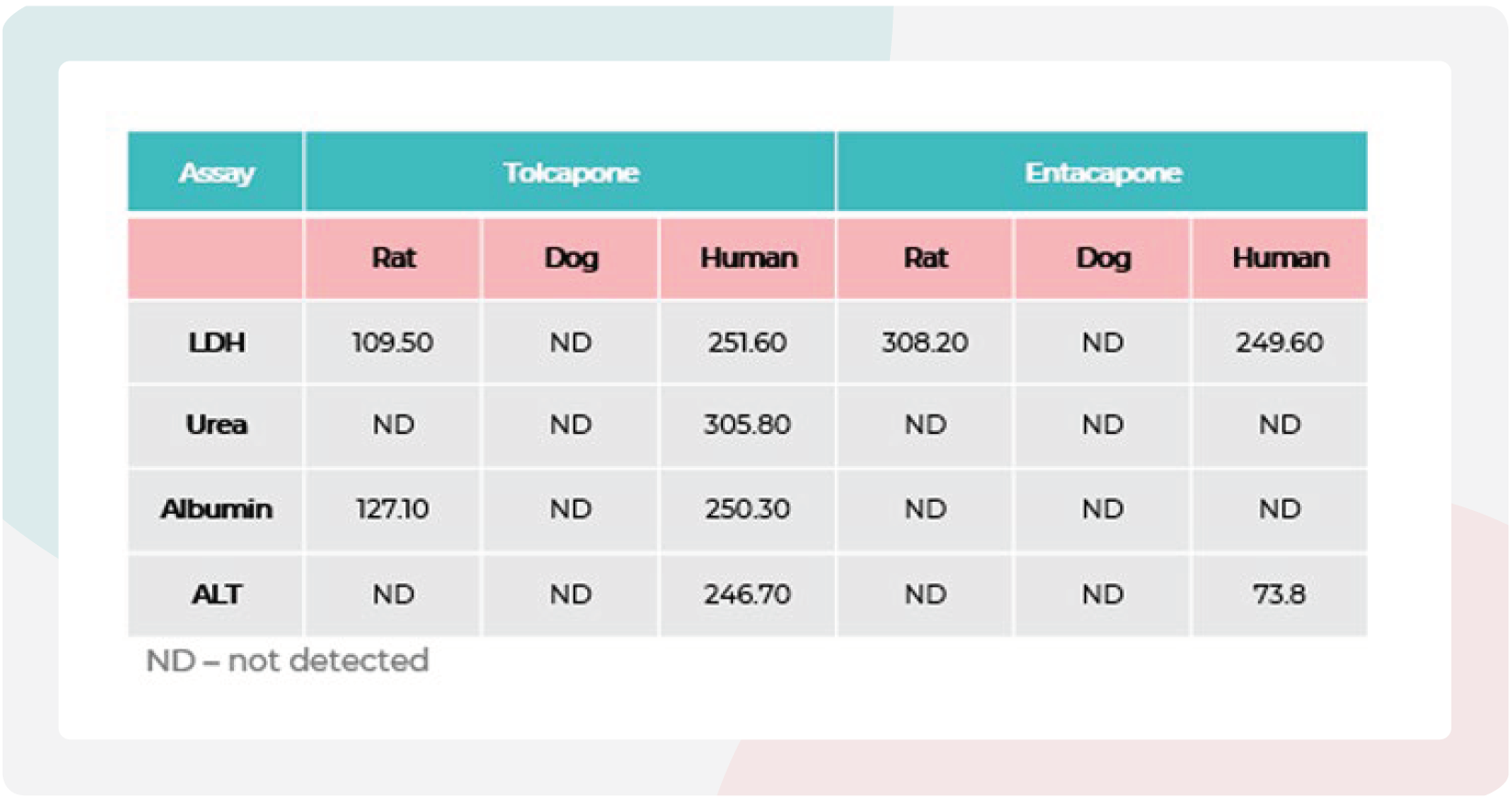
表3:托卡朋(tolcapone)与恩他卡朋(entacapone)在3D大鼠、犬和人肝脏MPS微组织中的毒性。
托卡朋(tolcapone)与恩他卡朋(entacapone)在3D大鼠、犬和人肝脏MPS微组织中的毒性。动物源肝脏微组织在MPS中暴露于托卡朋和恩他卡朋96小时。数据来源于七点浓度梯度的剂量–反应曲线,每个浓度设三个重复(N=3)。托卡朋和恩他卡朋的最高测试浓度均为300µM。
五、讨论
在临床试验前了解药物的风险特征对于确保患者安全很重要。大多数候选药物的安全评估仍然依赖于使用两种动物物种进行测试,然后才能开始首次人体试验。然而,由于认识到动物模型在某些情况下缺乏预测性,尤其是对于高度针对人类的新药模式(细胞治疗、小核酸、抗体等疗法),人们越来越倾向于采用如MPS这样的新方法(NAMs)。
FDA和IQ MPS联盟均强调了动物MPS作为体外到体内外推(IVIVE)建立信心的重要工具的作用,以及它作为一种精炼和减少体内实验的方法的重要性。通过将动物MPS数据与现有的体内数据进行比较,可以直接对比以展示其可转化性,并增强对人类MPS数据到临床应用的信心。这进一步增强了从人类MPS到临床转化的信心。此外,在进行法规要求的非临床研究之前,同时使用动物肝脏MPS和人类肝脏MPS可以预先理解物种间的反应差异,明确哪种测试物种更接近人类反应。这些早期的跨物种体外比较因此最小化了错误报告和不必要的动物使用的风险。
在本研究中,我们展示了PhysioMimix犬、大鼠肝脏MPS模型及其预测体内DILI风险的能力。基于文献报道的大鼠和犬肝脏重量、尿素和白蛋白生成的平均值,估计了每种物种每个肝脏中的细胞数量,并计算出总细胞数对应的蛋白质量来得出人与大鼠/犬的比例(图2A)。
培养时,犬白蛋白表达水平明显低于大鼠和人类(图2B)。粗略计算显示,尽管犬肝脏中细胞数量增加,但功能表达和输出并不比大鼠和人类有显著不同。因此,在相同细胞数接种的情况下,犬肝细胞产生的功能性标记物低于人类或大鼠是预期的结果。对此观察的进一步研究及与细胞供应商的讨论正在进行中。
在灌注条件下,两种肝细胞模型相比静态培养显示出增强的寿命和功能——维持LDH、尿素和白蛋白表达长达14天的培养期(图2B)。进一步优化培养基成分后,组织能在14天内保持良好状态,而商用培养基则未能支持一致的培养(图2C)。
使用IQ MPS联盟设定的已知DILI阳性和阴性化合物对模型进行了验证。例如,曲格列酮(DILI等级=8)是一个因严重肝毒性而在上市后撤市的药物的例子。在最近的一篇综述中,审查了体内模型预测曲格列酮毒性的能力。在审查的42项研究中,没有一项生物标志物分析显示出强烈的风险预警。大鼠ALT、AST、胆红素和肝脏重量的数据不确定。仅ALP在两项研究中显示出剂量-反应关系。
在我们的研究中,大鼠肝脏MPS微组织在给药48小时后对曲格列酮产生了急性毒性反应,表现为LDH和ALT释放轻微增加以及尿素产量减少。在较高浓度下还观察到了白蛋白释放显zhu减少。然而,由于之前的体内研究未报告白蛋白释放情况,因此无法直接比较这些结果(图3)。尽管如此,这突显了MPS在调查额外敏感功能标记物方面的效用,以便提供更全面的概述。对于新型治疗化合物,这些初步见解可用于更好地指导停止/继续决策,缩小化合物选择范围或改进体内研究设计以降低误分类风险。
本研究的结果反映了已发表的体内动物研究发现,即狗未报告曲格列酮的DILI潜力,但在大鼠中提出了潜在的毒性风险。当比较曲格列酮在两种测试物种中的IC50值与先前获得的人类肝脏MPS值时,观察到一些功能性的大鼠(而非狗)具有相似的IC50值,将曲格列酮标记为DILI阳性化合物。吡格列酮(DILI等级=3)的IC50值在大鼠或犬肝脏MPS物种中无法确定,也未在先前的人类肝脏MPS DILI检测中出现,这反映了体内观察到的情况及其安全的DILI等级状态(表1)。
动物模型往往难以准确捕捉由胆汁酸合成或运输紊乱引起的药物诱导肝损伤(DILI),这是由于不同物种之间产生的和代谢的胆汁酸类型以及胆汁酸转运蛋白表达和功能上的差异所致。曲格列酮肝毒性的关键机制之一是其代谢产物曲格列酮硫酸盐抑制胆盐输出泵(BSEP)。类似地,奈法唑酮(DILI等级=8)肝毒性的机制归因于常规胆汁酸运输的中断以及线粒体毒性。研究表明,Sprague-Dawley大鼠模型能够检测出血清胆汁酸浓度的瞬时变化,但此前发布的数据变化很大。在分离的大鼠肝线粒体中,奈法唑酮显zhu抑制呼吸作用。其结构相似的对应物丁螺环酮(DILI等级=3),通过作用于多巴胺和血清素受体用于一般抗焦虑治疗,被证明在这两个案例中都是安全的。
在我们的大鼠MPS研究中,通过白蛋白表达减少和尿素产量下降识别了奈法唑酮引起的急性肝毒性,但是其他标记物未能清晰地区分该药物为DILI阳性。在丁螺环酮的情况下,功能性标记物不受DILI阴性化合物的影响(图4-大鼠)。犬肝脏功能测试报告指出,在存在奈法唑酮时白蛋白表达减少且ALT水平略有增加,而丁螺环酮随着浓度增加反而降低了ALT水平(图4-犬)。
大鼠IC50值对于白蛋白和尿素,但不是LDH和ALT,与之前使用人类肝脏MPS获得的数据相当,但与犬相比有很大差异(表2)。这表明,这两种模型都无法像人类模型那样捕捉到奈法唑酮严重的肝毒性事件。有趣的是,大鼠MPS模型能够捕捉到随浓度增加的肝细胞功能变化。
托卡朋(DILI等级=8)和恩他卡朋(DILI等级=0)是以往用于帕金森病治疗的儿茶酚-O-甲基转移酶(COMT)抑制剂。托卡朋因导致数例严重肝毒性事件而从市场上撤回。在狗、大鼠或小鼠的临床前测试中未检测到肝脏功能障碍。然而,随后的研究表明,Sprague-Dawley大鼠中托卡朋而非恩他卡朋引起的肝毒性机制上与ATP/ADP比率的线粒体破坏有关。
在我们的DILI检测中,托卡朋在大鼠肝脏MPS中表现出急性毒性反应,表现为剂量依赖性增加的LDH和ALT以及在较高浓度下白蛋白产量减少。恩他卡朋在临床上相关的浓度范围内没有引起功能性标记物的变化(图5-大鼠)。暴露于托卡朋会导致犬肝脏微组织中白蛋白表达减少和ALT表达增加,而其他标记物保持不变。恩他卡朋在较高浓度下引起犬ALT表达轻微增加,但不影响其他功能性标记物(图5-犬)。
计算了托卡朋和恩他卡朋的IC50值并与先前使用人类MPS模型获得的DILI数据进行了比较。结果显示,大鼠MPS显示出与人类相似但略低的IC50值(表3)。这表明虽然大鼠模型可能能够标记化合物毒性,但剂量范围可能与人类患者不同,突显了将动物模型数据转化为临床应用的挑战。
总的来说,从跨物种体外DILI检测中测试的六种化合物获得的数据凸显了这些方法识别物种间差异的能力。在体内测试前使用跨物种检测可以使研究人员通过排除那些在临床前测试物种和人类中被视为潜在风险的化合物来缩小化合物选择范围,从而最小化并保护动物的使用。对于被认为在物种间安全的化合物,可以给予更大的信心进入非临床测试。这些跨物种检测可用于精炼并更好地指导动物安全性研究前的物种选择。例如,如果一个候选药物在人类和犬MPS中显示出安全性,但在大鼠中不安全,则可以进一步考虑非临床物种的选择。这类检测所产出数据的高内涵属性,进一步助力优化非临床研究设计,包括纳入更多生物标志物,从而更深入地揭示潜在毒性机制。
曼博生物:CN Bio正式授权的中国代理商
作为中国器官芯片领域的专业服务者与资源整合方,曼博生物专注于连接国际前沿技术与本土产业需求,致力于弥补国内器官芯片行业在技术标准化与产业链协同中的短板。通过引入经全球权威机构验证且应用互补的器官芯片技术,我们提供从技术适配、产品供应到场景化应用支持的综合服务,助力中国生物医药企业、科研机构及相关单位探索更优质、更符合伦理的药物研发路径,逐步推动器官芯片在药物开发、有效性评估、毒性评估等领域的实践应用。如果你正在准备动物替代实验、挑选器官芯片或想了解类器官领域,上海曼博生物将竭诚为您提供技术支持。
拓展阅读
参考链接
[1]Fogel, D. B. Factors associated with clinical trials that fail and opportunities for improving the likelihood of success: A review. Contemporary Clinical Trials Communications vol. 11 156–164 Preprint at https://doi.org/10.1016/j.conctc.2018.08.001 (2018).
[2]FDA. Roadmap to Reducing Animal Testing in Preclinical Safety Studies. FDA vol. 46 1–11 https://www.fda.gov/news-events/press-announcements/fda-announces-plan-phase-out-animal-testing-requirement-monoclonal_x0002_antibodies-and-other-drugs (2025).
[3]Watkins, P. B. & Ehitcomb, R. W. Hepatic Dysfunction Associated with Troglitazone. N Engl J Med 338, 916–917 (1998).
[4]Novac, O. et al. Human Liver Microphysiological System for Assessing Drug_x0002_Induced Liver Toxicity In Vitro. Journal of Visualized Experiments 2022, (2022).
[5]Baudy, A. R. et al. Liver microphysiological systems development guidelines for safety risk assessment in the pharmaceutical industry. Lab on a Chip vol. 20215–225 Preprint at https://doi.org/10.1039/c9lc00768g (2020).
[6]Dirven, H. et al. Performance ofpreclinical models in predicting drug-induced liver injury in humans: asystematic review. Sci Rep 11, (2021).
[7]Dragovic, S. et al. Evidence-based selection of training compounds for use in the mechanism-based integrated prediction of drug-induced liver injury in man. Archives of Toxicology vol. 90 2979–3003 Preprint at https://doi.org/10.1007/s00204-016-1845-1 (2016).
[8]Kostrubsky, S. E. et al. Inhibition of hepatobiliary transport as a predictive method for clinical hepatotoxicity of nefazodone. Toxicological Sciences 90, 451–459 (2006).
[9]Dykens, J. A. et al. In vitroassessment of mitochondrial dysfunction and cytotoxicity of nefazodone,trazodone, and buspirone. Toxicological Sciences 103, 335–345 (2008).
[10]Olanow, C. W. & Panel, T. A. Tolcapone and Hepatotoxic Effects.
[11]Haasio, K., Nissinen, E., Sopanen, L. & Heinonen, E. H.Different toxicological profile of two COMT inhibitors in vivo: The role ofuncoupling effects. J Neural Transm 109, 1391–1401 (2002).
[12]Haasio, K., Sopanen, L., Vaalavirta, L., Lindén,I.-B. & Heinonen, E. H. Comparative Toxicological Study on the HepaticSafety of Entacapone and Tolcapone in the Rat. J Neural Transm vol. 108 (2001).


 MineBio 精选
MineBio 精选  BioLamina人类重组层粘连蛋白
BioLamina人类重组层粘连蛋白